Questões de Concurso
Comentadas sobre soluções e substâncias inorgânicas em química
Foram encontradas 1.859 questões
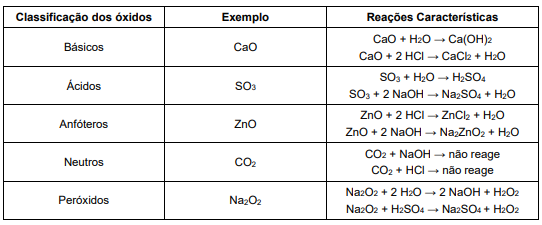
Ao observar a tabela, o professor precisou explicar ao estudante que um exemplo estava errado e não correspondia à classificação sugerida. A categoria cujo exemplo está incorreto é a dos óxidos:
Massas molares em g/mol: C = 12; O = 16; Ca = 40
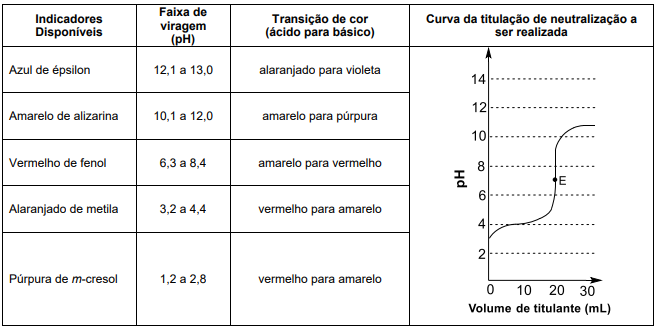
O indicador que o técnico deve utilizar é:

Nessa localidade há um rio em que ocorre despejo de efluentes industriais de uma empresa do ramo metalúrgico. Em um procedimento de fiscalização, uma amostra desse efluente foi coletada para análise e identificou-se a presença tanto de íons Cr2+ como de íons Hg2+ em concentrações de 1,0 x 10-3 g/L e 1,5 x 10-3 g/L, respectivamente. Considerando a densidade da amostra igual a 1g/cm3 , é correto afirmar que:
Uma solução de um composto molecular ioniza‑se dissolvido em água. É o caso, por exemplo, da solução de metanol (CH3OH), que é formada, majoritariamente, por íons H⁺ e íons CH3O⁻, com as moléculas dispersas por toda a solução.
Quando um sólido iônico é solubilizado em água, os íons em solução ficam rodeados por moléculas de água, sendo que a substância que forma essa solução aquosa é denominada eletrólito.
O ozônio (O3) é uma forma alotrópica de oxigênio, sendo encontrado na alta atmosfera e no ar poluído das grandes cidades.
Quando um ácido de Brønsted‑Lowry transfere um próton para uma base, a substância produzida nessa transferência é chamada de base conjugada do ácido. Da mesma forma, quando uma base de Brønsted‑Lowry recebe um próton, é formada outra substância, denominada ácido conjugado da base.
Uma substância iônica tem condutividade elétrica baixa, seja no estado sólido, no estado líquido (quando fundida) ou quando dissolvida em solução aquosa, por causa da retenção de seus íons ao deslocamento em direção aos polos da fonte externa de corrente elétrica aplicada.
Para que uma substância seja considerada uma base, cujo pH em solução deve ser maior do que 7, ela deve liberar íons positivos de hidrogênio (H⁺), quando dissolvida em solução aquosa.
Considerando as 06 etapas do preparo de soluções a partir de soluto sólido descritas abaixo, a homogeneização da solução, refere-se à seguinte etapa: Dissolver o soluto em um béquer usando uma pequena quantidade de solvente; Completar o volume com o solvente; Homogeneizar a solução; Transferir quantitativamente para o balão volumétrico; Guardar as soluções em recipientes adequados e rotulados; Pesar o soluto.
Se forem dissolvidos 4,9 g de H2SO4 em água suficiente para 0,5 litros de solução, dado que MM1 de H2SO4 = 98 g, a concentração molar (molaridade) será de:
Os ácidos comumente utilizados na digestão ácida de amostras minerais são
O objetivo da digestão ácida no tratamento de amostras minerais e ambientais é
É correto afirmar que o princípio que rege o equilíbrio ácido-base é o Princípio
Uma amostra de soda cáustica comercial foi analisada a fim de conhecer o teor de NaOH e a possível quantidade de Na₂CO₃ presente no produto como resultado da absorção de umidade e CO₂ do ar. Para isso, uma massa de 0,4903 g da amostra foi dissolvida, transferida quantitativamente para um balão volumétrico de 250 mL e o volume se completou com água destilada. Alíquotas de 25,00 mL foram tituladas com HCl 0,0510 mol L-1 gastando 20,40 mL até a mudança de cor da fenolftaleína e mais 2,10 mL para a virada do alaranjado de metila.
Dados: MM (NaOH): 40,00 g mol-1; MM (Na₂CO₃): 106,00 g mol-1
A porcentagem (% p/p) de NaOH e de Na₂CO₃ na amostra são, respectivamente,
Durante uma análise espectroscópica de absorção molecular no UV/Vis, um pesquisador estava investigando a concentração de uma solução de um corante desconhecido. Ele preparou soluções de concentrações conhecidas do corante e registrou os espectros de absorção para cada uma delas. Após analisar os dados, ele observou que a relação entre absorbância e concentração não era linear. Em vez disso, ele notou um aumento exponencial na absorbância com o aumento da concentração.
Tomando como base a interação do corante com a luz na faixa do UV/Vis, assinale a alternativa correta.