Questões de Concurso
Comentadas sobre substâncias e suas propriedades em química
Foram encontradas 383 questões
No tratamento da água para consumo humano são utilizados inúmeros produtos químicos, com características diversas, para a que a água alcance o padrão de potabilidade estabelecido pela Portaria de Consolidação nº 5/2017.
Assinale a opção que apresenta produtos químicos com características oxidante, coagulante, desinfetante, alcalinizante e fluoretante, respectivamente.
Atualmente, o combustível utilizado nos automóveis contém 27% em volume de etanol (álcool etílico) misturado à gasolina (octano).
F. Amarato e F. Matoso. Mistura de etanol na gasolina.
Internet: <http://g1.globo.com/economia/noticia/2015/03/mistura-de-etanol-na-gasolina-sobe-para-27-partir-de-16-de-marco.html>(com adaptações).
Considerando que foram usados 20,0 L do combustível referido no texto para abastecer um veículo, que as densidades do etanol e do octano sejam, respectivamente, 0,789 g/mL e 0,700 g/mL e que o combustível em questão seja formado exclusivamente por etanol e octano, é correto afirmar que a densidade do combustível é
Considerando-se que os óxidos são compostos inorgânicos com diversas aplicações na indústria química, julgue o item subsequente.
A matéria divide-se em substâncias puras, que podem ser
homogêneas ou heterogêneas, e misturas, que se subdividem
em elementos ou compostos.
A separação dos diferentes hidrocarbonetos de petróleo utiliza, como método, a destilação fracionada.
A separação de água e óleo também pode ser feita com o método de dissolução fracionada.
O texto retrata vários tipos de separações físicas da água do mar com o petróleo.
Via de regra, os aços mais dúcteis, largamente utilizados em elementos estruturais e tubulações, são aços:
O processo descrito é um exemplo de:
A técnica que consiste na separação de dois líquidos por meio do aumento da temperatura até atingir o ponto de ebulição de um deles, seguido pela condensação do vapor, é um exemplo de:
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

O fato de o NaCl fundir-se a 801 °C e o MgO fundir-se a 2.852 °C é uma evidência de que os sólidos iônicos são unidos por interações entre cátions e ânions, isto é, ligações iônicas.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

Os sólidos iônicos são cristalinos, e os sólidos moleculares são amorfos.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

No gráfico apresentado, o segmento de curva entre os pontos O e T representa a curva de sublimação, que separa a fase sólida da fase gasosa, e cada ponto desse segmento é uma condição de equilíbrio entre o sólido e o gás.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

No gráfico apresentado, os processos indicados pelas setas I e IV representam, respectivamente, os processos de vaporização e congelamento da referida substância.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

Nos líquidos, a ordem de ligação tem mais curto alcance que nos sólidos cristalinos.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

As moléculas se organizam por meio de ligações covalentes entre si para formar os sólidos moleculares.
Uma das principais vantagens da teoria de ligação de valência é a possibilidade de explicar, satisfatoriamente, fenômenos associados a estados de excitação e de prever os espectros de absorção e emissão de energia eletrônica das moléculas.
Nos compostos formados por cátions e ânions muito polarizáveis, o caráter da ligação química é fortemente covalente.
A molécula de N2H2 é linear e nela há uma dupla ligação entre os átomos de nitrogênio, sendo cada átomo de hidrogênio ligado a um dos átomos de nitrogênio.
De acordo com a teoria de ligação de valência, a molécula de água é constituída por quatro orbitais híbridos do tipo sp3 arranjados de forma tetraédrica em torno do oxigênio, de maneira que dois orbitais participam das ligações simples O–H e outros dois acomodam os pares de elétrons não ligantes.
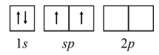
De acordo com a teoria de ligação de valência, o diagrama de orbitais para o átomo de Be, para formar orbitais híbridos no BeF2, está corretamente representado na figura a seguir.