Questões de Concurso
Comentadas sobre substâncias e suas propriedades em química
Foram encontradas 397 questões
Considere o texto e a figura a seguir para responder à questão.
Um quarto de quilograma de uma amostra de matéria desconhecida, inicialmente no estado sólido a 35°C, é aquecido à taxa de 150 calorias por minuto, e a variação de temperatura foi acompanhada conforme apresentado no gráfico da figura a seguir:

O hexafluoreto de urânio é uma substância de importância tecnológica, sendo utilizado como matéria prima para obtenção e enriquecimento do urânio metálico. A figura a seguir apresenta o diagrama de fases dessa substância:

IAEA - International Atomic Energy Agency. Disponível em: https://www.iaea.org (Adaptado).
Uma amostra de 704 g de hexafluoreto de urânio, inicialmente a 30°C e 1 atm, foi submetida aos seguintes procedimentos, realizados em sequência, em um laboratório:
1. aquecimento à pressão constante até 100°C;
2. compressão isotérmica (100°C) até 7 atm;
3. resfriamento à pressão constante (7 atm) até 20°C.
O hexafluoreto de urânio é uma substância de importância tecnológica, sendo utilizado como matéria prima para obtenção e enriquecimento do urânio metálico. A figura a seguir apresenta o diagrama de fases dessa substância:

IAEA - International Atomic Energy Agency. Disponível em: https://www.iaea.org (Adaptado).
Uma amostra de 704 g de hexafluoreto de urânio, inicialmente a 30°C e 1 atm, foi submetida aos seguintes procedimentos, realizados em sequência, em um laboratório:
1. aquecimento à pressão constante até 100°C;
2. compressão isotérmica (100°C) até 7 atm;
3. resfriamento à pressão constante (7 atm) até 20°C.
O hexafluoreto de urânio é uma substância de importância tecnológica, sendo utilizado como matéria prima para obtenção e enriquecimento do urânio metálico. A figura a seguir apresenta o diagrama de fases dessa substância:

IAEA - International Atomic Energy Agency. Disponível em: https://www.iaea.org (Adaptado).
Uma amostra de 704 g de hexafluoreto de urânio, inicialmente a 30°C e 1 atm, foi submetida aos seguintes procedimentos, realizados em sequência, em um laboratório:
1. aquecimento à pressão constante até 100°C;
2. compressão isotérmica (100°C) até 7 atm;
3. resfriamento à pressão constante (7 atm) até 20°C.
Assinale a alternativa que corresponde aos processos de mudança de fase relacionados às
etapas (1), (2) e (3), respectivamente.
Um copo Becher contém uma solução aquosa onde duas substâncias estão dissolvidas. Essa solução foi tratada com um reagente que formou um precipitado ao reagir com uma das substâncias. Todo o material foi transferido para um funil, com membrana, acoplado a um Kitasato conectado a uma torneira por uma trompa. Após filtragem, a solução do Kitassato foi transferida para um placa de Petri, que foi colocada numa estufa a 60°C. Após 24 h, o filme sólido na placa foi raspado e colocado em um frasco âmbar com tampa.
Com base no procedimento descrito, identificam-se quais métodos de separação?
Observe a tabela a seguir.
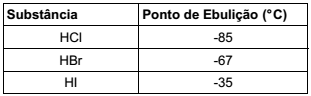
Forças intermoleculares mais fortes levam a pontos de ebulição mais altos, quando se aumentam os momentos dipolo e a
energia de interação dipolo-dipolo. No entanto, tal fator não é
observado nas substâncias apresentadas na tabela. A explicação para isso reside no fato de que
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
Com exceção do hélio, os gases nobres possuem oito elétrons
de valência e, por esse motivo, não são capazes de
compartilhar elétrons para formar ligações covalentes.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
A dissolução do gás carbônico na água para formação de água
gasosa se dá pela interação entre as moléculas de H2O e CO2,
por meio de forças intermoleculares do tipo dipolo-dipolo.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
As moléculas NH3 e BH3 apresentam diferentes geometrias
moleculares.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
A energia de ligação entre os átomos de flúor em uma
molécula de F2 é maior que a energia de ligação entre os
átomos de nitrogênio em uma molécula de N2.

A figura precedente mostra um diagrama de fase para uma
substância pura que exibe três fases: sólida, líquida e gasosa.
Com base nessas informações, julgue o item subsecutivo.
O ponto b indicado na figura precedente está corretamente localizado e representado pelo ponto I na curva de aquecimento seguinte.
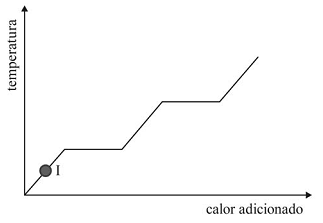

A figura precedente mostra um diagrama de fase para uma
substância pura que exibe três fases: sólida, líquida e gasosa.
Com base nessas informações, julgue o item subsecutivo.
No ponto a da figura do diagrama de fase, as fases gasosa,
líquida e sólida coexistem.

A figura precedente mostra um diagrama de fase para uma
substância pura que exibe três fases: sólida, líquida e gasosa.
Com base nessas informações, julgue o item subsecutivo.
A uma dada temperatura, a sublimação da substância em
questão é favorecida aumentando-se a pressão.

A figura precedente mostra um diagrama de fase para uma
substância pura que exibe três fases: sólida, líquida e gasosa.
Com base nessas informações, julgue o item subsecutivo.
O ponto c na figura representa o ponto normal de ebulição
da substância em questão.
Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
A partir de 18 °C, uma mistura de partes iguais em massa
de propanotriol e cicloexano se torna homogênea.
Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
O nitrato de cálcio é um exemplo de sólido iônico, formado
por íons, mas que apresenta ligações covalentes na sua
estrutura.
Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
Os sólidos moleculares são razoavelmente macios, têm
pontos de fusão baixos a moderados e apresentam baixa
condução térmica.

