Questões de Concurso
Comentadas sobre substâncias inorgânicas e suas características: ácidos, bases, sais e óxidos. reações de neutralização. em química
Foram encontradas 137 questões
Conforme a definição de Brønsted-Lowry, um ácido, tal como o H2S, é uma espécie que libera íons H+ em solução aquosa.
Reações de neutralização são reações entre um ácido e uma
base que produzem sal e água, de acordo com os conceitos de
Arrhenius. O sal inorgânico formado é então um produto iônico
dessa reação que ao ter contato com a água é dissolvido liberando
no mínimo um cátion diferente de H+ e no mínimo um ânion
diferente de OH-. Considerando a dissolução de um sal em uma
solução aquosa neutra, assinale a alternativa correta.
Resíduos de metais pesados gerados em laboratório químico podem ser tratados por reação de precipitação com carbonato, geralmente na forma de calcário. O sólido obtido é filtrado em papel e armazenado, sendo que o líquido filtrado é neutralizado antes do descarte. Para a separação de resíduos dos íons metálicos Pb2+ , Cd2+ e Cu2+, a precipitação ocorre de acordo com as seguintes reações:

Em relação às reações de precipitação e seus produtos de solubilidade (Kps), considere as afirmativas a seguir.
I - Cu2+ é o íon mais insolúvel da mistura na precipitação com íon 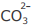
II - Pb2+ é o íon mais solúvel da mistura na precipitação com íon 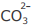
III - Cd2+ é mais insolúvel do que Cu2+ e Pb2+ na
precipitação com íon 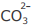
Está(ão) correta(s)
Para uma amostra de carvão, que vai utilizar a técnica aberta ou fechada, quais os ácidos indicados para esse tipo de digestão ácida?
■ NaOH ■ NaHSO4 ■ Na2CO3 ■ CH3CH2OH ■ C5H9CONH2
Qual das substâncias acima é a mais adequada para realizar o tratamento do resíduo?
I. SO3 II. Al2O3 III. NO2 IV. Fe3O4 V. Na2O2 VI. Na2O
Sobre as propriedades dessas substâncias químicas, assinale a alternativa correta.
Essa característica faz que uma solução de ácido sulfúrico de concentração 0,01 mol l-1 tenha um pH de ______ .
Assinale a alternativa que preench a correta e respectivamente as lacunas.
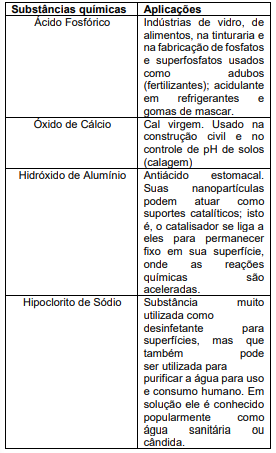
Assinale a alternativa que apresenta as fórmulas químicas que representam as substâncias presentes na tabela acima.
Em uma reação de neutralização, o reagente consumido em primeiro lugar é chamado de reagente limitante. A quantidade mínima de produto que pode ser formada depende da quantidade inicial desse reagente; o reagente presente em quantidade superior à necessária para reagir é chamado de reagente em excesso. Esse tipo de reagente em quantidade superior é totalmente utilizado pela reação, de modo que é inteiramente consumido.
Sais são substâncias sólidas que, quando dissociadas em água, formam soluções aquosas condutoras de eletricidade, sendo predominantemente compostos iônicos. Segundo a classificação de Arrhenius, os sais são substâncias que se dissociam em solução aquosa, originando, pelo menos, um cátion diferente de H+ e um ânion diferente de OH− . Sais hidratados são aqueles que apresentam água em sua estrutura cristalina.
As bases constituem um grupo de substâncias que podem formar soluções aquosas condutoras de eletricidade. De acordo com a definição de Arrhenius, as bases são substâncias que, quando dissolvidas em água, geram o cátion hidrônio (H3O+ ) e um ânion qualquer. As bases podem ser classificadas também de acordo com o grau de ionização ( α); bases fortes apresentam α < 5%.
Os ácidos são um grupo de substâncias que formam soluções aquosas condutoras de eletricidade e reagem com carbonatos e bicarbonatos, produzindo gás carbônico. Os ácidos podem ser também classificados de acordo com o número de hidrogênios ionizáveis; quanto maior o valor do grau de ionização, mais forte é o ácido.
A ionização ocorre quando uma molécula é quebrada em solução aquosa, produzindo íons de acordo com as diferenças de eletronegatividade, em que o elemento menos eletronegativo forma um cátion e o mais eletronegativo forma um ânion. Esse processo ocorre com compostos covalentes, como, por exemplo, o ácido clorídrico:

A dissociação iônica ocorre quando os íons que já existem nas substâncias se separam em solução aquosa nos seus respectivos cátions e ânions. Esse processo é característico de compostos iônicos, como é o caso do sal cloreto de sódio:


Considerando essas informações, assinale a opção correta.
O reagente que ele deve escolher é o