Questões de Concurso
Sobre técnicas de laboratório em química
Foram encontradas 2.777 questões
A imagem apresenta um microscópio óptico:
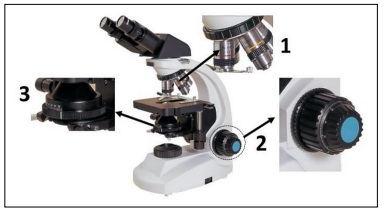
Considerando os componentes 1, 2 e 3 destacados na
imagem, assinale a afirmativa INCORRETA.
( ) Chinelos e sandálias no laboratório de química são permitidos. ( ) É proibido beber e comer no laboratório. ( ) Gravatas e lenços atados ao pescoço são proibidos no laboratório. ( ) Cabelos longos podem permanecer soltos, desde que não atrapalhem a visão. ( ) É recomendado o uso de roupas e jalecos de natureza sintética.
A sequência está correta em
Considere a imagem a seguir para a resolução da questão:
Considere a imagem a seguir para a resolução da questão:

Considere a imagem a seguir para a resolução da questão:

Considere a imagem a seguir para a resolução da questão:

(Dado: log 29 = 1,46.)
I. A extração em fase sólida apresenta algumas vantagens em relação à extração líquido-líquido convencional. Entre elas, menor consumo de solvente orgânico, a não formação de emulsões, facilidade de automação, volumes reduzidos de resíduos tóxicos, capacidade de aumentar seletivamente a concentração do analito. II. A quantidade de amostra e a concentração do analito são fatores fundamentais para a escolha do método analítico, uma vez que a concentração do analito influencia na ocorrência de erros interlaboratoriais. O desvio-padrão relativo aumenta drasticamente quando a concentração do analito na amostra que se encontra entre 1 ppb e 100 ppm passa para a faixa de 0,01% a 1%. III. Durante a preparação das amostras é fundamental a eliminação dos interferentes. Na espectroscopia de emissão atômica em plasma e em chama, as interferências físicas que, geralmente, são específicas a certos analitos ocorrem após a dessolvatação. Estes interferentes influenciam na volatilização das partículas do analito durante a conversão das partículas sólidas ou fundidas em átomos ou íons elementares. IV. A microextração em fase sólida utiliza uma fibra de sílica fundida recoberta com um polímero não-volátil capaz de realizar a extração de analitos orgânicos diretamente de amostras aquosas ou em espaço livre sobre as amostras (headspace). Os analitos são, posteriormente, desorvidos termicamente em injetor de um cromatógrafo a gás. Essa técnica combina a amostragem e a pré-concentração em uma única etapa.
Está correto o que se afirma apenas em
I. Esta técnica pode ser empregada na análise de substâncias voláteis e estáveis termicamente; caso contrário, há necessidade de se formar um derivado com essas características. II. A cromatografia gasosa limita-se como técnica qualitativa, não sendo possível a obtenção de resultados quantitativos em concentrações que variam de pictogramas a miligramas. III. É uma técnica com um poder de resolução excelente, tornando possível, muitas vezes, a análise de dezenas de substâncias de uma mesma amostra. IV. É uma técnica pouco sensível, independentemente do tipo de amostra analisada e do detector empregado.
Assinale
Das metodologias abaixo, qual está relacionada com análises de compostos orgânicos?
1. velocidade linear da fase móvel; 2. coeficiente de difusão do analito na fase estacionária; 3. diâmetro das partículas do “recheio” da coluna; 4. corrente de operação do detector; e 5. técnica de calibração adotada.
Dos itens acima os que exercem influência sobre a eficiência de separação da coluna são apenas as variáveis