Questões de Concurso
Sobre técnicas de laboratório em química
Foram encontradas 2.345 questões
Os vidros termoabsorventes são produzidos pela introdução de óxidos metálicos na massa do vidro.
Um erro bastante comum na determinação potenciométrica do pH com eletrodos de vidro é o erro ácido, causado, principalmente, pela saturação da membrana porosa de vidro com íons H+. Esse tipo de erro gera leituras de pH com resultados superiores aos reais.
Para uma análise química, uma amostra de laboratório deve
I. A filtração a vácuo, também chamada de filtração por pressão reduzida, é utilizada para processos nos quais a filtração comum é demorada.
II. A filtração a vácuo utiliza, além da aparelhagem padrão da filtração comum, a adição de um funil de Buchner, de um kitassato e de uma trompa de arraste (trompa d’água).
III. A pipeta volumétrica é utilizada para medidas de volumes variáveis de líquidos.
IV. A bureta é utilizada para realizar medidas precisas de volume, sendo também utilizada em titulações.
I. Líquidos inflamáveis devem ser armazenados em locais distantes daqueles em que se trabalha com chama.
II. Tubos de vidro podem ser encurvados, desde que amolecidos por aquecimento.
III. Acende-se um bico de Bunsen ligando-o à tomada elétrica.
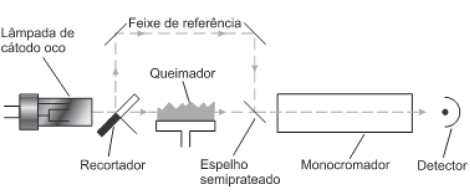
SKOOG, D. WEST, D. M. HOLLER, F. J. CROUCH, S. R Fundamentos de Química Analítica. 8 ed. São Paulo. Cengage Learning. 2010.
Ao considerar a instrumentação e os princípios da técnica analítica em si, analise as afirmações a seguir: I. A lâmpada de cátodo oco, consiste de um ânodo de tungstênio e de um cátodo cilíndrico selado em um tubo de vidro, contendo um gás inerte, como o monóxido de dinitrogênio. II. Como em toda a investigação relativa, há a necessidade de estipular um branco para a análise, já que no queimador podem surgir partículas que influem no sinal detectado e de natureza diferentes das que constituem a amostra analisada. III. A temperatura da chama é responsável pelas etapas de dessolvatação, vaporização e dissociação, bem como a conversão dos íons contidos na amostra em átomos neutros, estes últimos são os responsáveis por absorver o feixe de radiação.
É correto apenas o que se afirma em:
Um estudante pretende preparar uma solução 2,0 mol L-1 a partir do ácido clorídrico concentrado.
Ao abrir um manual elaborado por estudantes do Ensino Médio se deparou com as seguintes afirmações:
I. “Realizem o procedimento na bancada do laboratório, utilizando avental, óculos de segurança e luvas.”
II. “Retirem uma alíquota do ácido clorídrico concentrado vertendo-a em um béquer, pipetem o volume necessário a partir do béquer e transfira o volume para o balão volumétrico e adicionem água até o menisco e agitem.”
III. “Despejem cuidadosamente o volume pipetado de ácido clorídrico concentrado na água.”
IV. “Evite o contato dos vapores do ácido clorídrico com olhos e mucosas, lavando a mão com água ao término do procedimento.”
É correto apenas o que se afirma em:
O cromatograma a seguir refere-se a um processo de quantificação de captopril. Com base nas condições cromatográficas e em seus conhecimentos sobre CLAE, analise as propostas:
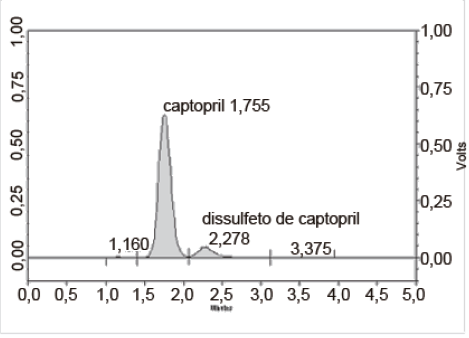
FIGURA 1 - Cromatrogama do captopril padrão secundário, fase móvel mistura de ácido fosfórico 0,11% (vlv) e metanol (45:55), vazão 1 mL/min, coluna C-18, comprimento de onda de detecção 220 nm e resolução média 2.2.
I. Uma boa resolução permite detecção de impurezas ou produtos de degradação do analito, por isso a importância dos sinais serem bandas estreitas.
II. O captopril possui melhor interação com a fase móvel utilizada que o dissulfeto de captopril.
III. A cromatografia foi feita em fase reversa.
IV. A eluição foi por isocrática e a detecção realizada na região do visível.
V. É comum acoplar detectores diferentes em sistemas CLAE.
São verdadeiras:
A figura a seguir apresenta um esquema simplificado de um equipamento de espectrofotometria de absorção molecular, analise as propostas apresentadas:
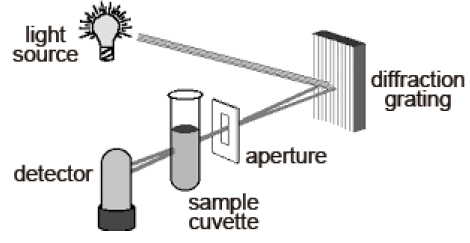
I. A rede de difração seleciona o comprimento de onda para se proceder na investigação, porém a seletividade do sistema está relacionada com a abertura da fenda de passagem de luz, quanto menor a fenda, mais específico será o comprimento de onda selecionado.
II. Absorbância está relacionada com a intensidade de luz visível que a amostra absorveu, sendo que se a cubeta apresentar maior ou menor caminho óptico o sinal de absorbância permanece o mesmo, já que a solução não foi alterada.
III. Soluções muito concentradas podem causar um bloqueio da luz incidente ao passar pela cubeta, fora da proporcionalidade, com isso ocorre um desvio de linearidade, além disso, este sistema também é prejudicado por material particulado ou manchas na superfície da cubeta.
São verdadeiras:
Um medicamento à base de ferro pode ter sua concentração conhecida por espectrofotometria UV/ Visível. Utilizando-se um medicamento de referência, realizaram-se as devidas diluições para a construção de uma curva de calibração. As medidas de absorbância, no comprimento de onda de absorção máxima de 510 nm, nas diferentes concentrações do medicamento de referência encontram-se na tabela a seguir:
Concentração (ppm) Absorbância
2,00 0,164
5,00 0,425
8,00 0,628
12,00 0,951
16,00 1,260
20,00 1,582
Os dados obtidos permitiram a construção de uma curva de calibração com coeficiente de correlação (R2) de 0,99978 e equação da reta: A = 0,01478 + 0,07812 x C. Sabendo-se que a absorbância da solução do medicamento à base de ferro foi de 0,715. Analise as propostas:
I. A concentração da amostra analisada é de 8,96 ppm.
II. O analito deve ser colorido, pois o comprimento de onda é na região do visível.
III. A absorbância está relacionada diretamente com a quantidade de radiação que atravessou a amostra analisada.
IV. A curva de calibração construída não se mostrou linear para o trecho estudado.
V. Se a amostra apresentar um valor de absorbância de 1,782 a concentração será de 22,60 ppm.
São corretas:
A análise quantitativa por espectrofotometria UV/Visível é muito utilizada para doseamento de determinados princípios ativos e corantes em formulações farmacêuticas disponíveis no mercado. Essa análise é confiável desde que obedeça a Lei de Beer, ou seja, a solução analisada deve obrigatoriamente seguir uma relação linear entre a absorbância e a concentração.
Considere a análise de um determinado fármaco que obedece a Lei de Beer. O que aconteceria com o valor de Absorbância se a concentração da solução do fármaco fosse o dobro? Considere que para esta análise utilizou-se uma cubeta de 1,00 cm de caminho óptico. O que aconteceria com o valor de Absorbância se uma nova medida fosse realizada com uma cubeta de 5,00 cm de caminho óptico?