Questões de Concurso
Sobre tipos de reações orgânicas: oxidação, redução e polimerização. em química
Foram encontradas 211 questões
Um agente redutor é uma substância que
Use: Ered Sn2+ = -0,14V , Ered Cu2+ = +0,34 V e F = 96485,33 C.mol-1
CCl4 → CHCl3 –1,0 V (vs ECS)
CHCl3 → CH4 –1,8 V (vs ECS)
Hg(l) → Hg2Cl2(s)
Em relação ao exposto, assinale a alternativa que apresenta corretamente o número de elétrons necessário para a redução de CCl4 a CH4.
Semirreação de oxidação:
CH3CH2OH + H2O → CH3COOH + 4H+ + 4e-
Semirreação de redução:
O2 + 4H+ + 4e- → 2H2O
Um motorista foi submetido ao teste do bafômetro e a reação no dispositivo, que ocorreu conforme descrito acima, oxidou 0,25 mol de etanol. Qual a carga elétrica em coulombs (C) transferida durante o teste? Considere a constante de Faraday como 96.485 C/mol de elétrons.
Considere a reação química representada pelo seguinte equilíbrio químico:
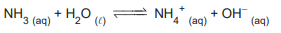
De acordo com a teoria ácido-base de Brönsted-Lowry,
nas reações direta e inversa, são classificados como ácidos, respectivamente:
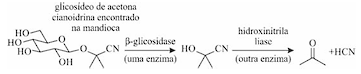
Depois do arroz e do milho, a mandioca é a terceira maior fonte de carboidratos das populações nos trópicos do planeta, fazendo parte da dieta básica de mais de meio bilhão de pessoas. A mandioca-brava, todavia, pode ser fatal para quem a consome, devido à presença do glicosídeo de acetona cianoidrina. O glicosídeo em si não é venenoso, mas as enzimas do intestino humano, quando o decompõem, liberam cianeto de hidrogênio (HCN), conforme a reação mostrada a seguir, que ocorre em duas etapas.
Jonathan Clayden, Nick Greeves e Stuart Warren. Organic Chemistry. 2. ed.
New York: Oxford University Press Inc., 2012 (tradução livre).
Uma pequena quantidade de HCN (a partir de 100 mg/kg
de mandioca) é suficiente para matar um ser humano após uma
refeição de mandioca não fermentada. Se, todavia, a mandioca
for esmagada com água e deixada em repouso, ela irá fermentar e
as enzimas da própria mandioca farão o mesmo trabalho e, então,
o HCN poderá ser eliminado antes de a mandioca ser cozinhada e
consumida — como o HCN é muito volátil, ele evapora na
temperatura de cozimento. A mandioca, após esse processo, é
segura para consumo, mas ainda contém algum glicosídeo.
Algumas doenças reportadas principalmente na África são
atribuídas ao consumo prolongado de mandioca-brava.
Tendo como referência inicial as informações e a imagem precedentes, julgue os itens a seguir.
Em uma solução alcalina, a segunda etapa da reação em tela
não necessitaria ser catalisada, pois isso seria uma condição
que favoreceria a conversão da cianoidrina em cetona, uma
vez que o cianeto é um bom grupo abandonador.
Depois do arroz e do milho, a mandioca é a terceira maior fonte de carboidratos das populações nos trópicos do planeta, fazendo parte da dieta básica de mais de meio bilhão de pessoas. A mandioca-brava, todavia, pode ser fatal para quem a consome, devido à presença do glicosídeo de acetona cianoidrina. O glicosídeo em si não é venenoso, mas as enzimas do intestino humano, quando o decompõem, liberam cianeto de hidrogênio (HCN), conforme a reação mostrada a seguir, que ocorre em duas etapas.

Jonathan Clayden, Nick Greeves e Stuart Warren. Organic Chemistry. 2. ed.
New York: Oxford University Press Inc., 2012 (tradução livre).
Uma pequena quantidade de HCN (a partir de 100 mg/kg
de mandioca) é suficiente para matar um ser humano após uma
refeição de mandioca não fermentada. Se, todavia, a mandioca
for esmagada com água e deixada em repouso, ela irá fermentar e
as enzimas da própria mandioca farão o mesmo trabalho e, então,
o HCN poderá ser eliminado antes de a mandioca ser cozinhada e
consumida — como o HCN é muito volátil, ele evapora na
temperatura de cozimento. A mandioca, após esse processo, é
segura para consumo, mas ainda contém algum glicosídeo.
Algumas doenças reportadas principalmente na África são
atribuídas ao consumo prolongado de mandioca-brava.
Tendo como referência inicial as informações e a imagem precedentes, julgue os itens a seguir.
O tamanho dos substituintes desempenha papel central nas
reações orgânicas e é a razão pela qual os aldeídos são mais
reativos que as cetonas, por exemplo. O impedimento
estérico afeta as taxas de reação e também pode determinar o
mecanismo de reação.
Sabendo que todo o peróxido de hidrogênio foi decomposto em água e gás oxigênio, quantos mols de água oxigenada foram consumidos?
Dado: o volume molar de um gás ideal, nas CNTP, vale 22,4 L.
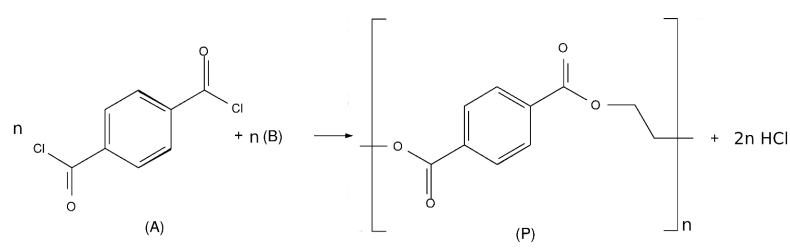
Para obtenção do produto (P), o derivado de cloreto de acila (A) deve reagir com o reagente (B), que é o:
“Além do ácido sulfúrico, o Falso Geber descreveu também como fazer ácido nítrico forte.”
STRATHERN, Paul. O Sonho de Mendeleiev - A verdadeira história da Química. 2002. Zahar.
Os métodos usados por alquimistas, ainda que rudimentares, permitiram o isolamento de ácidos acético, lático, sulfúrico e nítrico. O último, conhecido na época como água forte, se destacava pela “assombrosa capacidade de dissolver quase tudo, exceto ouro”.
[Dados: Potenciais de Redução Padrão:
2H+ + 2e- → H2 E0 = 0,00 V NO3- + 4H+ + 3e- → NO + 2H2O E0 = 0,96 V NO3- + 2H+ + e- → NO2 + H2O E0 = 0,80 V Cu2+ + 2e → Cu E0 = 0,34 V]
Tomando o cobre como exemplo, a capacidade do ácido nítrico dissolver esse metal deve ser, à luz do conhecimento atual, justificada pela
I. Os polímeros de adição necessariamente devem possuir uma dupla ligação nos seus monômeros constituintes. II. O monômero colrato de vinila polimeriza-se em policlorato de vinila (PVC). III. Polímeros de condensação são obtidos por reações em que um álcool reage com um ácido carboxílico ou um ácido reage com uma amina, porém ambos têm que ter dois grupos funcionais para haver a reação de polimerização.
Estão corretas as afirmativas:
Durante o ano de 2020, impulsionado pela necessidade de respostas rápidas e eficientes para desinfectar ambientes de possíveis contaminações com o SARS-CoV-2, causador da covid-19, diversas alternativas foram buscadas para os procedimentos de descontaminação de materiais e ambientes. Entre elas, o uso de ozônio em meio aquoso como agente sanitizante para pulverização em humanos e equipamentos de proteção em câmaras ou túneis, higienização de automóveis e de ambientes fechados e descontaminação de trajes. No entanto, pouca atenção foi dada à toxicidade do ozônio, à formação de subprodutos, ao nível de concentração segura e às precauções necessárias.
LIMA, M. J. A.; FELIX, E. P.; CARDOSO, A. A. Aplicações e implicações do ozônio na indústria, ambiente e saúde. Química Nova, n. 9, 2021 (adaptado).
O grande risco envolvido no emprego indiscriminado dessa substância deve-se à sua ação química como
O silício elementar pode ser obtido em escala laboratorial por redução com metais básicos, a partir do dióxido de silício ou tetrafluoreto de silício, conforme os exemplos a seguir.
SiO2 + 2 Mg → Si + 2 MgO
3SiO2 + 4 Al → 3Si + 2Al2O3
3SiF4 + 4Al → 3Si + 4 AlF3
Em relação às substâncias apresentadas, assinale a alternativa correta.
Assinale a alternativa que apresenta a variação de energia livre da reação de oxidação da glicose, em kJ.
C6H12O6(s) + 602(g) → 6CO2(g) + 6H2O(l)
Considere as energias livres de formação a seguir.
Gfo (C6H12O6) = -910 kJ/mol, Gfo (H2O) = -237 kJ/mol e Gfo (CO2 )= -394 kJ/mol