Questões de Concurso
Comentadas sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 285 questões
Algumas propriedades periódicas, como o raio atômico e a energia de ionização, apresentam padrão de comportamento geral diferenciado se comparado ao padrão dos elementos de transição, principalmente os lantanídeos e os actinídeos.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
Na produção do sódio metálico, é possível realizar a eletrólise do NaCl na forma sólida.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
A partir da localização do N a e do K na tabela periódica, é correto concluir que a eletrólise do KC1 requer a aplicação de um potencial elétrico maior que aquele requerido para a eletrólise do NaCl.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
A formação de 2,0 g de sódio metálico deve ser acompanhada pela formação de uma massa superior a 4,0 g de Cl2.
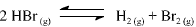
Com base nessas informações, julgue o item que se segue.
A partir dos valores da constante de equilíbrio fornecidos, é correto afirmar que a reação de decomposição do HBr(g) em H2 (g) e Br2 (g) é endotérmica.
Considere que a reação química apresentada a seguir tenha ocorrido em meio aquoso, e que a velocidade dessa reação e a extensão na qual ela procede, para direita, podem ser prontamente avaliadas pela observação da cor vermelho-alaranjada do íon triiodeto I3- (os outros participantes da reação são incolores).
H3AsO4 + 3I- + 2H+ ↔ H3AsO3 + I-3 + H2O
Considerando essas informações, julgue o item subsecutivo.
Considerando a reação H3AsO3 + I-3 ↔ H3AsO4 + 3I- + 2H+ , é correto afirmar que, ao se adicionar 1 mmol de ácido arsenioso, H3AsO3, a 100 mL de uma solução, contendo 1 mmol de íon triiodeto, a solução produzida será incolor.
A introdução de átomo de halogênio no anel aromático do esqueleto básico de substâncias ilícitas se tornou uma importante ferramenta para a obtenção de novas drogas sintéticas, o que deixou o mercado ilegal dessas substâncias um passo a frente da legislação que controla o tráfico de drogas. Considerando essas informações e as figuras I e II, acima, que representam, respectivamente, estruturas químicas de algumas drogas sintéticas comuns e as dessas mesmas drogas, na forma halogenada, julgue o item que se segue.
O tratamento de aminobenzeno com ácido nitroso e ácido tetrafluorobórico, seguido de aquecimento, leva à formação de fluorbenzeno,
e nitrogênio molecular.
A introdução de átomo de halogênio no anel aromático do esqueleto básico de substâncias ilícitas se tornou uma importante ferramenta para a obtenção de novas drogas sintéticas, o que deixou o mercado ilegal dessas substâncias um passo a frente da legislação que controla o tráfico de drogas. Considerando essas informações e as figuras I e II, acima, que representam, respectivamente, estruturas químicas de algumas drogas sintéticas comuns e as dessas mesmas drogas, na forma halogenada, julgue o item que se segue.
4-BMC é o produto regioisomérico majoritário da reação entre efedrona e bromo molecular na presença de tribrometo de ferro.
A reação química entre 2,5-DMA com formaldeído e ácido fórmico tem como produto uma substância química com fórmula molecular C12H19NO2.
2KNO3(s) + S(s) + 3C(s) -> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
A redução do nitrato, que consome três moles de elétrons por mol de NO3 – em meio ácido, gera o óxido nítrico, que é um agente complexante mais forte que o íon nitrato
2KNO3(s) + S(s) + 3C(s) -> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
Se o gás carbônico reagir com a água para formar o ácido carbônico, o CO2 receberá um par de elétrons da água, que é uma base de Lewis.
2KNO3(s) + S(s) + 3C(s)-> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
O nitrato reage com a água conforme a reação NO3 – + H2O -> 6 HNO3 + OH– , aumentando significativamente o pH da solução formada, haja vista que o caráter básico do OH– é mais forte que o caráter ácido do NO3 – .
A transformação de carbonato de cálcio em óxido de cálcio pode ser representada pela equação a seguir:
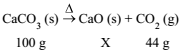
A massa, em gramas, correspondente a X é igual a
