Questões de Concurso
Comentadas sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 285 questões
Julgue o item de quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
Quando em solução aquosa, o carbonato de cálcio sofre hidrólise, produzindo uma base fraca, cuja reação é descrita quimicamente conforme a seguir.
CaCO3 (s) + 2 H2O (l) --> Ca(OH)2 (aq) + H2 (g) O2 (g) + CO2 (g)
 A figura acima mostra a tabela periódica proposta por
Mendeleev, em 1869. Ao longo de cento e cinquenta anos,
a tabela foi sofrendo modificações, como o acréscimo de
novos componentes e o agrupamento dos elementos de
acordo com características comuns. Atualmente os
elementos estão classificados em metais, ametais (não
metais), gases nobres e hidrogênio.
Assinale a seguir um exemplo de ametal:
A figura acima mostra a tabela periódica proposta por
Mendeleev, em 1869. Ao longo de cento e cinquenta anos,
a tabela foi sofrendo modificações, como o acréscimo de
novos componentes e o agrupamento dos elementos de
acordo com características comuns. Atualmente os
elementos estão classificados em metais, ametais (não
metais), gases nobres e hidrogênio.
Assinale a seguir um exemplo de ametal: Referente à seguinte reação:
Mg (s) + O2 (g) MgO(s) ------------>
analise as assertivas e assinale a alternativa que aponta as corretas.
I. É uma reação de combinação.
II. A molécula de oxigênio é formada por ligação iônica.
III. A queima de 2 mol de Mg(s) resulta em 1 mol de MgO.
IV. O produto da reação é um sólido iônico.
Texto 19A1AAA
O titânio, um metal de transição do “bloco d” da tabela periódica, é bastante empregado em ligas metálicas devido a sua elevada resistência mecânica e baixa tendência à corrosão, além da baixa densidade. Ele é obtido a partir, principalmente, da ilmenita (FeTiO3) e do rutilo (TiO2).
Texto 19A1AAA
O titânio, um metal de transição do “bloco d” da tabela periódica, é bastante empregado em ligas metálicas devido a sua elevada resistência mecânica e baixa tendência à corrosão, além da baixa densidade. Ele é obtido a partir, principalmente, da ilmenita (FeTiO3) e do rutilo (TiO2).
As características químicas da água ocorrem em função da presença de substâncias dissolvidas, geralmente mensuráveis apenas por meios analíticos.
Relacione a COLUNA II com a COLUNA I associando os indicadores químicos das águas às suas propriedades.
COLUNA I
1. Dureza
2. Alcalinidade
3. Corrosividade
4. Salinidade
COLUNA II
( ) Indicador caracterizado pela presença de ácidos minerais ou soluções de oxigênio que atuam sobre os metais.
( ) Característica conferida à água pela presença de sais de metais alcalino-terrosos e alguns outros metais em menor quantidade.
( ) Presença na água de substâncias como bicarbonatos, cloretos e sulfatos, conferindo a ela um sabor característico.
( ) Característica decorrente da presença de bicarbonatos, carbonatos e hidróxidos, quase sempre de metais alcalinos ou alcalino-terrosos.
Assinale a sequência correta.
A Aspirina, como é conhecida o ácido acetilsalicílico (C9H8O4), é um fármaco que apresenta propriedades antitérmicas, anti-inflamatórias e analgésicas. Esse fármaco pode ser sintetizado pela reação entre o ácido salicílico (C7H6O3) e o anidrido acético (C4H6O3), catalisada por um ácido.
A equação a seguir representa o processo de síntese da aspirina.
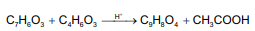
Considere, hipoteticamente, que 3 g de ácido salicílico foram misturados com 6 mL de uma solução de anidrido acético cuja densidade e grau de pureza são 1,2 g/mL e 80% m/m, respectivamente.
Se o rendimento da reação química é 100%, qual a
massa aproximada de aspirina produzida em gramas?
A reação mostrada abaixo é classificada como:
CaC03 → CaO + C02
Considerando a reação química mostrada abaixo:

A fórmula química do composto desconhecido (X)
corresponde a:
Muitas reações químicas inorgânicas podem ser classificadas em reações de síntese ou de análise ou de simples troca ou de dupla troca. Nesse contexto, relacione a COLUNA II com a COLUNA I, classificando as reações químicas.
COLUNA I
1. Reação de síntese
2. Reação de análise
3. Reação de simples troca
4. Reação de dupla troca
COLUNA II
( ) 3 H2(g) + N2(g) → 2 NH3(g)
( ) NaCl + AgNO3 → AgCl + NaNO3
( ) 2 NaN3(s) → 3 N2(g) + 2 Na(s)
( ) 2 Fe(s) + 6 HCl(aq) → 2 FeCl3(aq) + 3 H2(g)
Assinale a sequência correta.
"A pedra constituída
De ferro, níquel e encanto.
Até o dia de hoje
Provoca tristeza e encanto
Queremos nossa pedra de volta
De volta pro nosso canto."
Cordel: A Saga da Pedra do Bendegó.
A pedra do Bendegó foi encontrada próximo ao riacho de Bendegó, na Bahia, na cidade de Monte Claro, em 1784. Bendegó é um
As letras W, X, Y e Z representam átomos de quatro elementos e suas distribuições eletrônicas.
As letras não correspondem aos símbolos dos elementos.
Relacione os elementos às suas respectivas características.
W – 2 : 4
X – 2 : 8 : 1
Y – 2
Z – 2 : 8 : 14 : 2
( ) Gás inerte menos denso que o ar.
( ) Reage com a água, produzindo uma base e gás hidrogênio, liberando grande quantidade de calor.
( ) Metal do quarto período da tabela periódica.
( ) Ametal típico das moléculas orgânicas.
Assinale a opção que mostra a relação correta, segundo a ordem apresentada.
Considere a reação ácido-base de Lewis entre gás clorídrico e amônia:
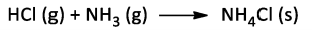
Considerando 100% de rendimento, calcule o volume mínimo da mistura equimolar dos reagentes, a 27ºC e 1 atm, de
modo que seja possível a obtenção de 10,7g do produto. Massas molares (g/mol): H = 1; N = 14; Cl = 35,5.
