Questões de Concurso
Comentadas sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 605 questões
Com base nessas informações, julgue o próximo item.
A degradação do ozônio é uma reação de dissociação.
Com base nessas informações, julgue o próximo item.
A etapa II do mecanismo proposto, em que a molécula de
ozônio reage com o oxigênio atômico, é bimolecular.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O hélio é o único gás nobre que não tem 8 elétrons em sua
camada de valência.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
Na tabela periódica moderna, não é utilizada a classificação
semimetais.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
A eletronegatividade é a quantidade de energia envolvida no
processo em que o átomo isolado em seu estado fundamental
recebe um elétron.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O modelo atômico de Bohr permitiu a Mendeleev
estabelecer a tabela periódica.
Para a eliminação completa de 12 mg de metanfetamina do corpo, são necessárias mais de 6 × 1020 moléculas de gás oxigênio.
Partindo das informações anteriores e considerando que MCO2 = 44,00 g/mol e MC10H15N = 149,00 g/mol sejam, respectivamente, as massas molares do CO2 e do C10H15N, e que a constante de Avogadro (NA) valha 6 × 1023 mol−1, julgue o item subsequente.
Para a eliminação completa de 16 mg de metanfetamina do
corpo, serão formados mais de 40 mg de gás carbônico,
considerando-se um rendimento de 80% desse processo.
I. Os elementos em um grupo da tabela têm propriedades similares porque apresentam o mesmo tipo de organização dos elétrons na periferia dos átomos. II. Todos os metais, com exceção do mercúrio, são sólidos à temperatura ambiente. III. Enxofre, fósforo, selênio e telúrio são elementos não-metálicos.
Está correto o que se afirma em
25 mL de HCl aproximadamente 0,1 mol/L com NaOH padronizado como 0,1000 mol/L
25 mL de CH3COOH aproximadamente 0,1 mol/L com NaOH padronizado como 0,1000 mol/L
São feitas as seguintes afirmações sobre as titulações:
I - O pH no ponto de equivalência é 7 em ambas as titulações.
II - O pH no ponto de equivalência é neutro na titulação HCl/NaOH e básico na titulação CH3COOH/NaOH.
III - O pH no ponto final é básico em ambas as titulações.
IV - O volume gasto em ambas será de aproximadamente 25 mL de NaOH.
Quais estão corretas?
(1) Ácido de Lewis ( ) NH3
(2) Base de Arrhenius ( ) CH3COOH
(3) Base fraca de Bronsted-Lowry ( ) KNO3
(4) Ácido forte de Bronsted-Lowry ( ) HCl
(5) Componente ácido de tampão ( ) NH4Cl
(6) Componente salino de tampão ácido ( ) BF3
(7) Sal ácido ( ) CH3COONa
(8) Sal neutro ( ) KOH
A sequência numérica correta de preenchimento dos parênteses da coluna da direita, de cima para baixo, é
H2S LiOH CuBr2 NaNO3 KF SO3 Na2O
Pode-se afirmar que as soluções apresentam, da esquerda para a direita, valores de pH a 25 ºC, conforme listados a seguir:
Para a obtenção de óxido de ferro (II), foi realizado um experimento em triplicata, envolvendo a queima de limalha de ferro. As massas, em gramas, de ferro e oxigênio usadas e os resultados do experimento estão relacionados no quadro a seguir.
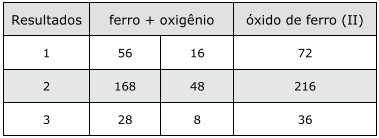
Com relação aos resultados obtidos, analise as afirmativas a seguir.
I - A razão das massas encontrada entre o ferro e o oxigênio é de 7/2.
II - No óxido de Fe(II), a proporção entre as massas de ferro e oxigênio será sempre constante.
III - A composição percentual de FeO será 70% de ferro e 30% de oxigênio.
Está(ão) correta(s)
Um laboratório recebeu uma amostra de calcário para que fosse analisado o seu grau de pureza. Pela decomposição de 240 g de calcário, foram produzidos 107 g
CaCO3 (s) → CaO (s) + CO2 (g)
A pureza encontrada, em percentagem, teve seu
valor mais próximo de
No que se refere a noções de tabela periódica, ligação química e estrutura molecular, julgue o item seguinte.
Os elementos da coluna 4A da tabela periódica possuem
quatro elétrons na última camada e, por isso, não apresentam
tendência para perder ou ganhar elétrons e sim para
compartilhar seus elétrons com outros átomos.
C2H6O + O2 → CO2 + H2O
Para a reação descrita, 3,0 g de C2H6O foi adicionado a um ambiente contendo 100,0 g de oxigênio. A massa (g) de CO2 produzida será, aproximadamente, de:
Dados de massas molares: C = 12 g/mol, H = 1 g/mol e O = 16 g/mol.
A aula experimental em laboratório de química configura uma atividade cujo objetivo é exercitar a observação e evidenciar a transformação química, seja pela mudança de coloração, formação de precipitados ou liberação de gases.
O trecho foi extraído de uma apostila de aulas experimentais de química. Nesse experimento, o aluno deverá perceber a formação de um precipitado amarelo.
Com o desenvolvimento dessa atividade, o aluno poderá perceber e concluir sobre a possível ocorrência de uma reação
