Questões de Concurso Público SEEDUC-RJ 2015 para Professor Docente I - Química
Foram encontradas 30 questões
1ª etapa: (CH3 )3 Br → (CH 3) 3C+ + Br - (I)
2ª etapa: (CH3 )3 C+ + OH- → (CH3 )3 COH (II)
Um per?l de reação genérico (esboçado) do processo é indicado no grá?co que segue:

Dado: pKa do ácido acético = 4,74
I – NaCl II – KBr III – MgCl 2 IV – AlCl 3 V – LiF

I – propan-1-ol
II – etoxietano
III – propanona
IV – propan-2-ol
V – butano
Aquele que apresenta o maior valor de ponto de ebulição é o composto representado por:
Dados de Kps :
BaCO3 = 5,0.10-9 ,
MnCO3 = 5,0.10-10 ,
Ag2 CO3 = 8,1.10-12 ,
ZnCO3 = 1,0.10-11

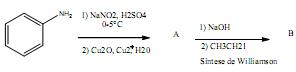
A fórmula estrutural correta do composto B é:
Dados: massas molares (g.mol -1 ), Ba=137, C=12, O=16, S=32
Dados: 1 mol de elétrons = 96500 C (1 F), massa molar do Al = 27g.mol -1