Questões de Concurso Público Petrobras 2010 para Técnico de Inspeção de Equipamentos e Instalações Júnior
Foram encontradas 50 questões
I – Haverá formação de gás no polo negativo (catodo).
II – O pH da solução tende a diminuir em função da formação de íons H+ no anodo.
III – A concentração de íons I - tende a diminuir na solução.
IV – A concentração de íons Na+ tende a diminuir na solução.
Dados: ε0[Na+(aq)/Na(s)] = −2,71V
ε0[H2O(l)/H2(g),OH−(aq)] = −0,83V
ε0[I2(g)/I−(aq)] = +0,54 V
ε0[O2(g), H+(aq)/H2O(l)] = +1,23V
Estão corretas APENAS as afirmativas
Cu(s) | Cu2+(aq, 1,0 mol/L) || Cl -1 (aq, 1,0 mol/L) | Cl2(g, 1,0 atm) | Pt(s)
Dados os potenciais padrões de redução:
ε0[Cu2+(aq)/Cu(s)] = +0,34V
ε0[Cl2(g)/Cl - (aq)] = +1,36V
No processo eletroquímico em questão, a(o)
I – Os catalisadores aumentam a velocidade da reação, pois diminuem a energia de ativação da mesma.
II – A presença de catalisadores não influencia na variação de entalpia da reação química.
III – A presença de um catalisador altera o valor da constante de equilíbrio da reação.
IV – O emprego de níquel sólido na redução de alquenos é um exemplo de catálise heterogênea.
Estão corretas APENAS as afirmações
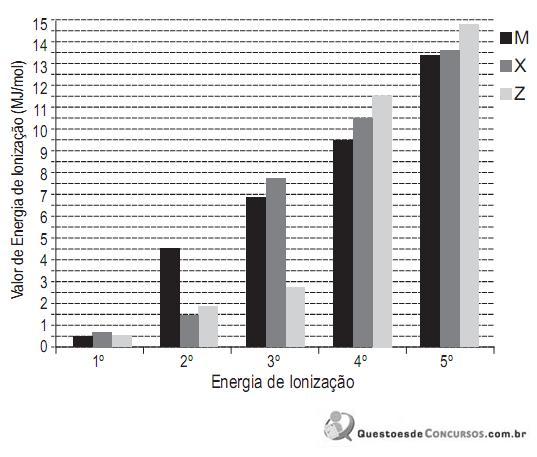
Analisando o gráfico, verifica-se que
O teste envolve a observação do composto CrO5 em fase orgânica, uma vez que esse composto é altamente instável em meio aquoso. Caso o solvente orgânico não seja adicionado, observam-se a coloração característica dos íons cromo III e a liberação de gás oxigênio.
A equação devidamente balanceada da reação entre as soluções de peróxido de hidrogênio e de dicromato de potássio em meio ácido, sem adição de solvente orgânico, é
• solução de tiossulfato de sódio;
• dióxido de manganês;
• carbonato de cálcio;
• zinco metálico.
Sobre essas reações, analise as afirmativas a seguir.
I - O ácido clorídrico atua como agente oxidante do tiossulfato na reação Na2S2O3(aq)+2 HCl(aq) → 2 NaCl(aq)+ SO2(g)+H2O(l)+S(s)
II - O dióxido de manganês atua como agente oxidante do cloreto na reação MnO2(s) + 4 HCl(aq) → MnCl2(aq) +Cl2(g) + 2 H2O(l)
III – O carbonato de cálcio é oxidado pelo ácido clorídrico na reação CaCO3 (s) + 2 HCl(aq) → CaCl2 (aq) +CO2(g) + H2O(l)
IV – O zinco metálico é oxidado pelo ácido clorídrico na reação Zn(s) + 2 HCl(aq) → ZnCl2(aq) + H2(g)
Estão corretas APENAS as afirmativas
hidrogênio. Quando ele se sente ameaçado, essas substâncias se misturam e, através de uma catálise enzimática, há a formação de p-benzoquinona, que é expelida sob a
forma de uma solução quente, de acordo com a reação abaixo.
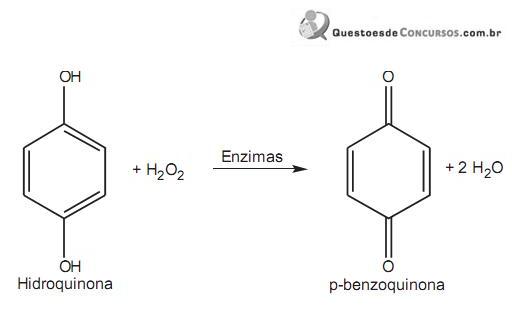
Nessa reação de oxirredução,
I – A quantidade de prata depositada na terceira cuba é 4,59 g.
II – Há produção de gás oxigênio apenas na segunda cuba.
III – A quantidade de ácido sulfúrico permanece constante na segunda cuba.
IV – O volume de oxigênio produzido, nas CNTP, na segunda cuba, é de 0,24 L.
Dado: Volume molar dos gases na CNTP = 22,4 L.mol –1
Estão corretas APENAS as afirmativas
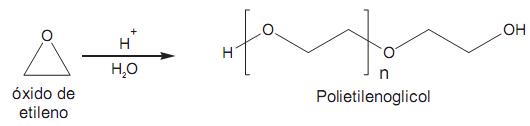
O polietilenoglicol é
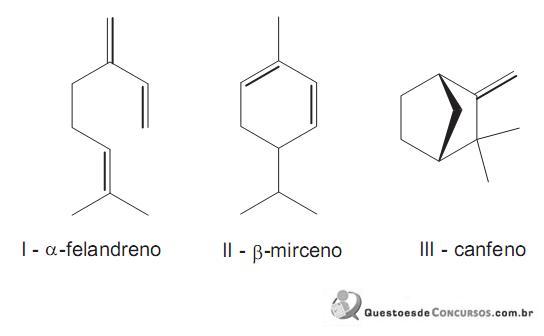
Analisando os monoterpenos I, II e III ilustrados acima, conclui-se que
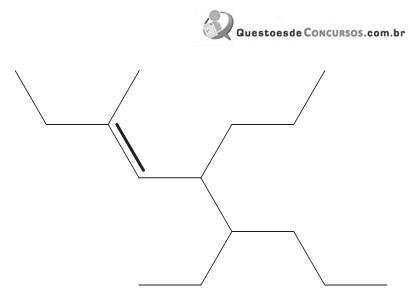
Segundo a IUPAC, a nomenclatura do hidrocarboneto acima é
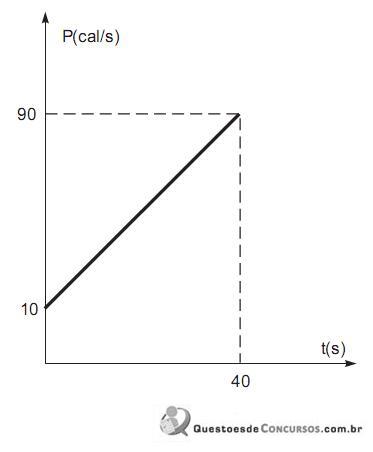
Sabe-se que, durante o intervalo de tempo representado no gráfico, todo o calor produzido pela fonte térmica é utilizado no aquecimento do bloco. Com base nessas informações, o calor específico da substância que constitui o referido corpo, em cal/g. o C, vale
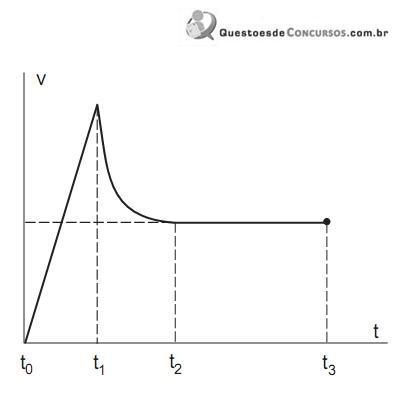
O instante de abertura do paraquedas e os dois intervalos de tempo em que, no movimento, há aceleração não nula são, respectivamente,
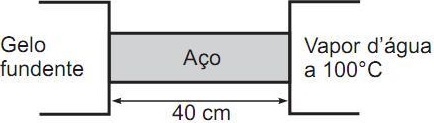 Dados: - Calor latente de fusão do gelo LF = 80 cal/g
Dados: - Calor latente de fusão do gelo LF = 80 cal/g- Condutibilidade térmica do aço KAÇO = 0,1 cal/s.cm.oC
Considere que: (1) o regime seja estacionário; (2) não haja perdas de calor lateralmente; (3) o gelo e o vapor d’água só troquem calor com a barra. O valor da temperatura, em Celsius, em um ponto de uma seção transversal da barra, situado a 10 cm do gelo, e o valor da massa de gelo, em gramas, que se funde, após 40 min, são, respectivamente,
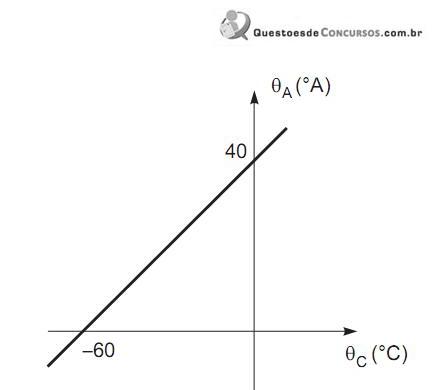
Com base no gráfico, a temperatura referente à ebulição da água, sob pressão normal, na escala A, é
Dados: - calor específico do gelo cgelo = 0,5 cal/g.°C
- calor especifico da água cágua = 1,0 cal/g.°C
- calor latente de fusão do gelo LF = 80 cal/g
Sabendo-se que a fonte térmica que cede calor ao gelo tem potência nominal constante de 305 cal/s, e que todo o calor transferido ao bloco seja por ele utilizado, exclusivamente, ou para variar a sua temperatura ou para mudar seu estado físico, o intervalo de tempo, em segundos, necessário para que seja alcançado o desejado, é

Dados:
- coeficiente de dilatação volumétrica do vidro γV = 24 x 10–6 °C–1
- coeficiente de dilatação volumétrica da glicerina γG = 49 x 10–5 °C–1
- π = 3
A altura da coluna de glicerina, em centímetros, no interior do tubo a 80 °C, está entre