Questões de Concurso Público Petrobras 2010 para Técnico Químico de Petróleo Júnior
Foram encontradas 50 questões
Uma definição muito comum e que possibilita tal medida é considerar que o raio atômico é a metade da distância entre os núcleos de átomos vizinhos de uma substância simples. Essa definição permite a determinação de raios atômicos para grande parte dos elementos, mas alguns deles não podem ter seus valores de raio determinados segundo essa metodologia, por não formarem substâncias simples com ligações entre os átomos. Um exemplo desses elementos é o
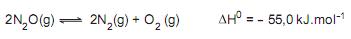
apresenta energia de ativação igual a 121 kJ.mol -1 , se ouro for empregado como catalisador e 134 kJ.mol -1 se, alternativamente, platina for empregada como catalisador. Sobre esse sistema fechado, considere as afirmativas a seguir
I – Um aumento de temperatura diminuiria o tempo para se atingir o equilíbrio e aumentaria o rendimento do processo.
II – O emprego de ouro como catalisador conduz o processo mais rapidamente ao equilíbrio, quando comparado ao emprego de platina.
III – A uma dada temperatura, o emprego dos catalisadores ao processo altera a velocidade da reação, no entanto as concentrações dos gases no equilíbrio permanecem inalteradas.
IV – Um aumento da pressão total do sistema (pela diminuição do volume) levaria a um aumento do rendimento da reação no equilíbrio.
Estão corretas APENAS as afirmativas
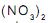 de concentração igual a 1,0 mol.L-1 e deixadas em repouso por algumas horas. Sendo dados os potenciais padrão de redução:
de concentração igual a 1,0 mol.L-1 e deixadas em repouso por algumas horas. Sendo dados os potenciais padrão de redução: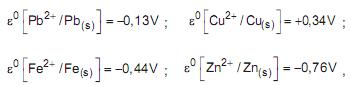
será observada oxidação APENAS na(s) placa(s) de
I - Em uma série de soluções-padrão, de um determinado analito quanto mais fraca for a cor da solução, maior será a transmitância.
II - O caminho ótico é o diâmetro externo da cubeta e não o seu diâmetro interno.
III - A absorvância é diretamente proporcional ao poder radiante e ao comprimento de onda.
Está correto APENAS o que se afirma em
O buraco na camada de ozônio era causado por gases conhecidos como CFC’s, os cloro-flúor-carbonos, que interferiam no equilíbrio existente entre o gás oxigênio e o ozônio. Analise as afirmações abaixo sobre o ozônio e o oxigênio.
I - A hibridação do oxigênio central do ozônio é sp2 e a geometria molecular é angular.
II - O ozônio e o gás oxigênio por serem formados pelo mesmo elemento, são isômeros.
III - As ligações entre os oxigênios são mais fracas no ozônio que no gás oxigênio.
IV - O ozônio e o gás oxigênio são conhecidos pelo forte caráter redutor.
Estão corretas as afirmativas
Um exemplo de danos materiais (e também culturais) causado pela chuva ácida ocorre na Grécia, onde diversos monumentos históricos feitos de mármore foram danificados, forçando o governo a trocar algumas esculturas por réplicas. Os principais agentes da chuva ácida são óxidos do nitrogênio e do enxofre. Considere que 3,20 g de enxofre foram queimados em excesso de gás oxigênio, originando o óxido onde o enxofre se encontra em seu maior estado de oxidação. Tal óxido foi recolhido em quantidade suficiente de água em um erlenmeyer onde foi introduzido um pedaço de mármore de 10,00 g. Se todas as etapas do processo apresentam rendimento de 100 %, e apenas 80,0 % do mármore é formado por carbonato de cálcio, ao final da última reação, a massa de gás liberada, em g, foi de
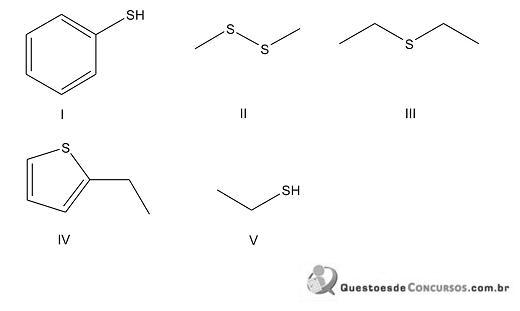
A respeito dos compostos I, II, III, IV e V acima representados, tem-se que
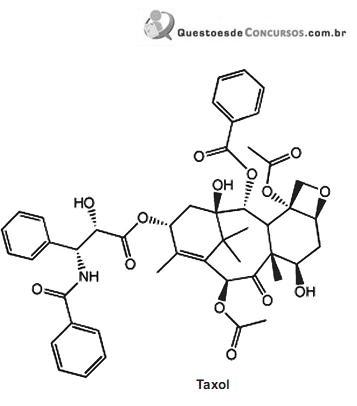
O taxol é um diterpenoide natural que possui uma enorme atividade anticancerígena.
O único grupo funcional que NÃO está presente no taxol denomina-se
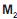 O e MO. Considere as afirmações abaixo sobre esse elemento e seus compostos.
O e MO. Considere as afirmações abaixo sobre esse elemento e seus compostos.I - O elemento M pertence ao grupo dos metais alcali- nos.
II - No composto MO, o oxigênio apresenta estado de oxidação -1.
III - O elemento M apresenta dois estados de oxidação.
IV - No composto
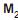 O, o oxigênio apresenta estado de oxidação -2.
O, o oxigênio apresenta estado de oxidação -2.São corretas APENAS as afirmativas
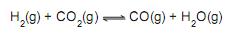
A constante de equilíbrio em termos das concentrações molares (Kc) a 750 °C para esse sistema é igual a
Dado: R = 0,082 L atm K-1 mol -1 = 8,31 JK-1 mol -1
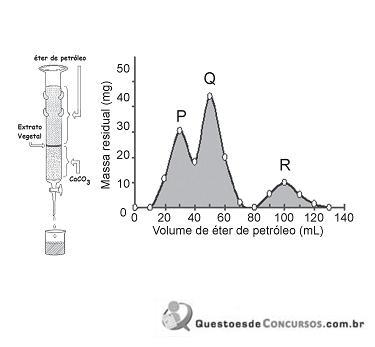
A separação cromatográfica dos componentes de um extrato vegetal foi feita a partir da técnica clássica usando
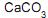 como fase estacionária e éter de petróleo como fase móvel. A aparelhagem, de acordo com a figura ao lado, consistiu de uma coluna de vidro preenchida com camada compacta de
como fase estacionária e éter de petróleo como fase móvel. A aparelhagem, de acordo com a figura ao lado, consistiu de uma coluna de vidro preenchida com camada compacta de 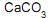 , no topo da qual foi depositado o extrato vegetal (amostra). O leito da coluna foi lavado continuamente com éter de petróleo e os componentes do extrato, por sua vez, foram separados. Frações de 10 mL de éter de petróleo foram recolhidas, uma a uma, até totalizar 140 mL. Cada uma das frações foi evaporada sob vácuo até secar totalmente e a massa residual de cada fração foi medida. O cromatograma ao lado foi construído a partir dos valores de massa residual na respectiva fração de 10 mL, em função do somatório dos volumes de éter de petróleo coletados desde o início da corrida cromatográfica.
, no topo da qual foi depositado o extrato vegetal (amostra). O leito da coluna foi lavado continuamente com éter de petróleo e os componentes do extrato, por sua vez, foram separados. Frações de 10 mL de éter de petróleo foram recolhidas, uma a uma, até totalizar 140 mL. Cada uma das frações foi evaporada sob vácuo até secar totalmente e a massa residual de cada fração foi medida. O cromatograma ao lado foi construído a partir dos valores de massa residual na respectiva fração de 10 mL, em função do somatório dos volumes de éter de petróleo coletados desde o início da corrida cromatográfica.Sobre os componentes, P, Q e R do extrato vegetal e a ordem de eluição observada no cromatograma, constata-se que
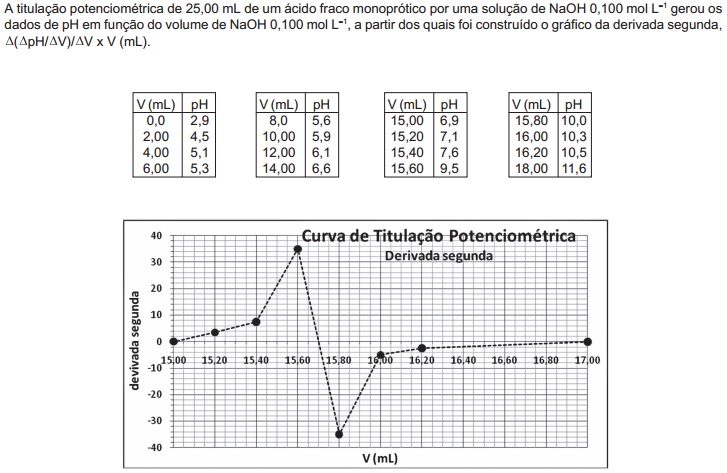
De acordo com os dados da tabela e do gráfico acima, o volume de equivalência e o valor do pKa desse ácido fraco são,respectivamente,