Questões de Concurso Público LIQUIGÁS 2011 para Técnico Químico
Foram encontradas 11 questões
 foi medida usando-se cinco balanças analíticas. Devido a problemas com a calibração dessas balanças, os resultados obtidos foram ligeiramente diferentes, como os apresentados abaixo. A medida com o maior número de algarismos significativos é
foi medida usando-se cinco balanças analíticas. Devido a problemas com a calibração dessas balanças, os resultados obtidos foram ligeiramente diferentes, como os apresentados abaixo. A medida com o maior número de algarismos significativos é Reação 1:
2 Mg(s) + O2 (g) 2MgO(s): reação que acontece em flashes descartáveis de fotografia.
Reação 2:
2NaN3 (s) 3N2 (g) + 2Na(s): reação advinda do acionamento de dispositivos de segurança presentes nos automóveis, chamados airbags. A decomposição do NaN3 (s) origina N2 (g), que os faz inflar.
Reação 3:
Zn(s) + 2HC(aq) ZnC
 2 (aq) + H2 (g): reação que ocorre quando uma lâmina de zinco é colocada em uma solução aquosa de ácido clorídrico, havendo a formação do ZnC
2 (aq) + H2 (g): reação que ocorre quando uma lâmina de zinco é colocada em uma solução aquosa de ácido clorídrico, havendo a formação do ZnC 2 (aq) e gás hidrogênio.
2 (aq) e gás hidrogênio.Reação 4:
BaC
 2 (aq) + Na2 SO4 (aq) BaSO4 (s) + 2 NaC(aq): a reação de cloreto de bário com sulfato de sódio produz o cloreto de sódio e o sulfato de bário precipitado.
2 (aq) + Na2 SO4 (aq) BaSO4 (s) + 2 NaC(aq): a reação de cloreto de bário com sulfato de sódio produz o cloreto de sódio e o sulfato de bário precipitado. Após analisar essas reações, uma estudante de Química fez as seguintes afirmações:
I – As reações 1 e 3 são de “síntese”, e a reação 2 é de “decomposição”.
II – As reações 3 e 4 são, respectivamente, de “simples troca” e de “dupla troca”.
III – A reação 2 é de decomposição.
IV – A reação 1 é de síntese.
Com base na teoria das classificações das reações químicas, a estudante fez afirmações corretas APENAS em
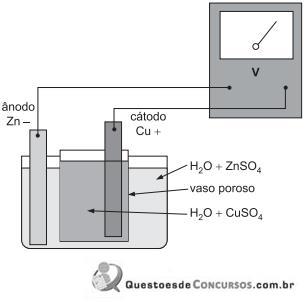
Disponível em: http://www.cis.udel.edu/*portinoi/academic/academic? les/daniellcell.html
A figura acima representa, esquematicamente, uma pilha de Daniel.
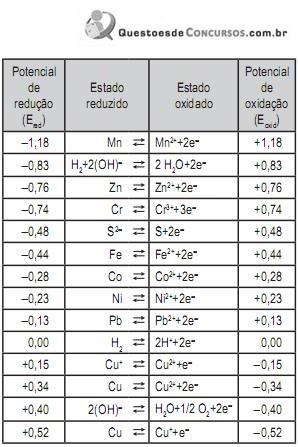
Admitindo-se concentrações (atividades) normais (1,0 M) dos sais, qual a leitura, em V, indicada pelo medidor de força eletromotriz?
Na reação de combustão do metano, qual é a quantidade de O2 (g), em mols, necessária para que 6 mols de CH4 (g) sejam completamente consumidos na reação, produzindo CO2 (g) e H2 O?
 em peso), completando-se com água até um volume final de 2,0 L.
em peso), completando-se com água até um volume final de 2,0 L. Qual o teor residual de prata na solução?
Dado: Ks AgC
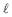 = 1,8 x 10-10
= 1,8 x 10-10 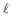 foram consumidos.
foram consumidos. Qual a relação molar NaOH/Na2 CO3 presente na solução analisada?
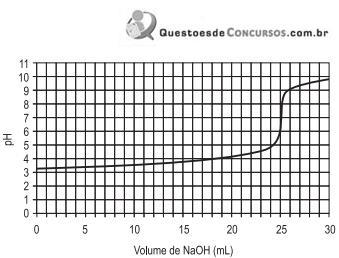
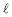 0,0005M foi analiticamente padronizada, titulando-se um volume de 50 mL dessa solução com uma solução 0,001M de NaOH, sendo acompanhado o parâmetro pH durante a adição da solução de NaOH.
0,0005M foi analiticamente padronizada, titulando-se um volume de 50 mL dessa solução com uma solução 0,001M de NaOH, sendo acompanhado o parâmetro pH durante a adição da solução de NaOH. A curva titulométrica resultante é apresentada no gráfico.
VOGEL, A. I. Análise Química Quantitativa. Rio de Janeiro: LTC, 2002. Adaptado.
Indicador Faixa de pH de mudança de cor
Vermelho de metila 4,2 – 6,3
Verde de bromocresol 3,8 – 5,4
Azul de bromotimol 6,2 – 7,6
Alaranjado de metila 3,1 – 4,4
Fenolftaleína 8,3 – 10,0
Considerando-se os indicadores ácido-base listados após o gráfico, qual o indicador apropriado para a realização dessa análise?
I – C6 H4 (CH3 )OH
II – C6 H5 CH2 OH
III – C6 H5 COCH3
IV – C6 H5 CH2 COH
P – Álcool
Q – Fenol
R – Cetona
S – Ácido
T – Aldeído
As associações corretas são:
2 H+ + 2 e → H2
H2 O→2 H+ + ½ O2 + 2 e
Considere as seguintes afirmativas:
I – Os potenciais normais de eletrodo são independentes do pH.
II – A diferença de potencial normal da célula é independente do pH.
III – Os sobrepotenciais são independentes da composição da solução.
De acordo com o exposto acima, está correto o que se afirma em