Questões de Concurso Público Innova 2012 para Técnico Químico Júnior
Foram encontradas 17 questões
Na comparação de dois átomos, tem-se que o raio atômico do
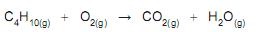
A massa de butano, em gramas, que mais se aproxima do valor que dá origem a 67,2 L de CO2 , nas condições normais de temperatura e de pressão, e considerando o comportamento de gás ideal (no qual o volume molar é igual a 22,4 L), é

É correto APENAS o que se afirma em
Considere o esquema de uma pilha constituída de duas semipilhas com metais mergulhados em soluções aquosas de seus íons (Zn em Zn(NO3) 2(aq) e Cu em Cu(NO3)2(aq)) e unidas por um tubo de vidro em U contendo um eletrólito em solução saturada (ponte salina), fios conectados aos metais e um voltímetro (V). Nesse sistema, ocorre uma reação espontânea representada por:
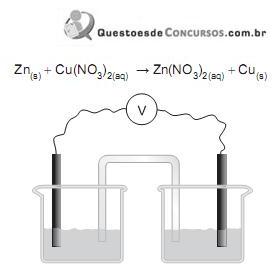
Nessa pilha
Considere a gasolina comercial como sendo constituída de 25%, em volume, de etanol (CH 3 CH2 OH) e 75%, em volume, de octano (C8 H18 ), e as equações termoquímicas a seguir.
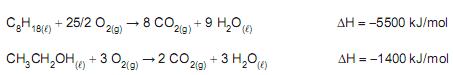
O valor que mais se aproxima do calor (em kJ, na pressão constante de 1 atm) produzido pela queima de 1,00 L de gasolina comum é
Dados
(CH3 CH2 OH) = 46 g/mol
(C8 H18) = 114,2 g/mol
dCH3CH2OH = 0,80 kg/L
dC8H18 = 0,70 kg/L