Questões de Concurso Público Petrobras 2017 para Técnico de Operação Júnior
Foram encontradas 14 questões
Um vaso de 3 m3 contendo uma mistura de hidrocarbonetos, hermeticamente fechado, opera inicialmente a 3 x 105 Pa. Sem haver entrada ou saída de material, o vaso sofre uma remoção de calor de 895 kJ, mediante um sistema de resfriamento, tendo sua pressão reduzida para 2,8 x 105 Pa.
Nessa condição, a variação da entalpia do vaso, em kJ, foi de
O tricloreto de fósforo (PCℓ3) é um composto químico muito utilizado como matéria-prima para obtenção de diversos compostos organofosforados. Ele é comumente preparado, sob condições adequadas, de acordo com a equação química balanceada representada a seguir.
P4(s) + 6 Cℓ2(g) → 4 PCℓ3(l)
O valor mais próximo da massa, em gramas, de PCℓ3 que se formaria a partir de 12,4 g de P4 e 30,0 g de Cℓ2, considerando um rendimento de 100%, seria
Dados
M (P4) = 123,9 g mol-1
M (Cℓ2) = 70,9 g mol-1
M (PCℓ3) = 137,3 g mol-1
Uma solução aquosa de bicarbonato de sódio (NaHCO3) foi preparada em um balão volumétrico de 250,00 mL utilizando-se 10,0 g do soluto, com o volume final ajustado pela adição de água pura. Dessa solução foi retirada uma alíquota de 25,00 mL, que foi transferida para um balão de 100,00 mL, no qual o volume final foi ajustado pela adição de água pura.
Os valores mais próximos das concentrações, em quantidade de matéria (mol L-1), da solução inicial e da solução após a diluição são, respectivamente,
Dado
M (NaHCO3) = 84,0 g mol-1
Policaprolactona, cuja sigla é PCL, é um polímero biodegradável muito utilizado como aditivo em resinas, e acrilonitrila-butadieno-estireno, cuja sigla é ABS, é um polímero que possui elevada resistência, portanto, é utilizado na fabricação de capacetes, entre outros objetos.
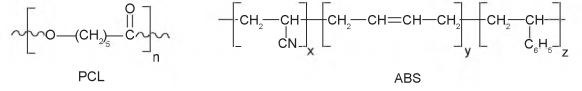
PCL e ABS são, respectivamente:
As substâncias inorgânicas possuem diversas aplicações: o Aℓ2(SO4)3 é utilizado em uma das etapas do tratamento de água, o H2SO4 é matéria-prima para produção de fertilizantes, o Aℓ (OH)3 é empregado em medicamentos, e o Aℓ2O3 é utilizado na fabricação de materiais cerâmicos.
A respeito dessas substâncias, verifica-se que o
Considere as seguintes equações químicas de oxirredução balanceadas a seguir:
Fe2O3(s) + 3 CO(g) → 2 Fe(s) + 3 CO 2(s) (I)
2 K(s) + 2 H2O(ℓ) → 2 KOH(aq) + H2(g) (I)
2 NaBr(aq) + Cℓ2(g) → 2 NaCℓ(aq) + Br2(ℓ) (III)
Em cada uma das equações, o agente oxidante é a espé
cie química:
Os hidrocarbonetos representados a seguir, e identificados por I, II e III, são compostos orgânicos relativamente simples, pois são constituídos exclusivamente por átomos de carbono e hidrogênio.
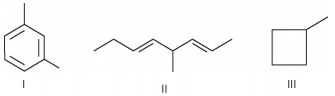
Os compostos I, II e III correspondem aos tipos
O clorato de potássio (KClO3), quando aquecido, se decompõe segundo a equação química abaixo.
2 KClO3(s) → 2 KCℓ(s ) + 3O2(g)
Uma mistura com massa desconhecida contém apenas KCℓO3 e KCℓ e foi aquecida produzindo 0,175 mol do gás oxigênio proveniente da reação de decomposição completa do KCℓO3. Após o aquecimento, a massa final de KCℓ foi de 25,0 g.
Dessa forma, a massa total aproximada, em gramas, da mistura que foi aquecida era de
Dados
M(KCℓ) = 75 g mol-1
M (KCℓO3) = 123 g mol-1
O gás dióxido de enxofre (SO2) reage com o gás NO2 formando o trióxido de enxofre, que promove a acidificação da água da chuva.
SO2(g) + NO2(g) ⇌ SO3(g) + NO(g)
A constante de equilíbrio (Kc) dessa reação é igual a 25 a 400 K. Nessas condições, coloca-se em um reator, de volume fixo, a quantidade de gases necessária para se ter, inicialmente, 1 mol L-1 de cada um dos quatro gases.
Ao se atingir o equilíbrio, a concentração de SO3(g) no sistema, em mol L-1, será mais próxima de
Nanopartículas esféricas de ouro são estruturas que contêm centenas de átomos de Au. A superfície dessas nanopartículas apresenta carga elétrica advinda de uma camada de íons provenientes do reagente usado na redução do Au3+ para o Au que forma a nanopartícula. A elevada relação superfície-volume e a carga superficial mantêm as nanopartículas dispersas homogeneamente no meio aquoso.
Considerando que cada uma das nanopartículas tenha 100 átomos de Au e que a concentração de Au3+ na reação que originou a dispersão era de 1 x 10-6 mol L-1, o número de nanopartículas de ouro em 5 mL de dispersão aquosa será de
Dado
1 mol de átomos = 6 x 1023 átomos
CO2(g) ⇌ CO2(aq)
CO2(aq) + H2O(ℓ) ⇌ H2CO3(aq)
H2CO3(aq) ⇌ HCO3-(aq) + H+(aq)
A composição da solução e o efeito de eventuais perturbações deste sistema são tais que a(o)
Uma amostra contém Ba2+ e Ca2+ nas concentrações de 1 x 10-2 mol L-1 para cada íon. Esses íons devem ser precipitados na forma de sulfatos pouco solúveis, como apresentado nas equações abaixo.
BaSO4(s) ⇌ Ba2+(aq) + SO42-(aq) ; Kps1 = 1 x 10-10
CaSO4(s) ⇌ Ca2+(aq) + SO42-(aq) ; Kps2 = 1 x10-5
Quando a concentração de SO42- atingir um valor para permitir o início da precipitação do CaSO4, a concentração de Ba2+ na solução estará na ordem de grandeza, em mol L-1, de
O tolueno (C7H8) é um hidrocarboneto líquido (densidade 0,87 g mL-1) em condição ambiente, que é usado como solvente de tintas, e como antidetonante em misturas combustíveis. O tolueno reage completamente com oxigênio, conforme indicado na equação:
2 C7H8(ℓ) + 18 O2(g) → 14 CO2(g) + 8 H2O(g) : AH° = - 7 500 kJ
Se a queima completa, e em excesso de oxigênio, de uma determinada quantidade de tolueno produziu energia na forma de calor igual a -30.000 kJ, então o volume de tolueno que reagiu (em L e com dois algarismos significativos) foi
Dado
M (C7H8) = 92,0 g mol-1