Questões de Concurso Público Petrobras 2018 para Técnico Químico de Petróleo Júnior
Foram encontradas 38 questões
A cromatografia líquida de fase reversa foi usada para separar dois analitos em uma amostra, usando fase móvel de composição constante. O pico do analito I apareceu no tempo de retenção de 5,40 min, enquanto o pico do analito II saiu com tempo de retenção de 7,20 min. Os picos do cromatograma, para os dois analitos, foram finos, simétricos e sem cauda. A detecção foi feita por fotometria de absorção, medindo-se no comprimento de onda máximo de cada analito com a altura do pico do analito I sendo o dobro da do analito II, e sabe-se que o analito I e o analito II têm absortividades molares bem diferentes.
Com base nessas informações, conclui-se que o(a)
Um sal possui várias características.
NÃO constitui uma dessas características
Um recipiente de volume igual a 1 m3 contém gás hélio com pressão parcial de 15 atm. Uma quantidade desse gás foi transferida, sem perda significativa, para um outro recipiente, inicialmente vazio e de volume igual a 5 m3 , até que a pressão parcial do hélio atingisse, nesse último, a pressão de 2 atm. As medições de pressão foram feitas quando o gás estava na temperatura de 298 K, e as condições foram ideais.
A massa de gás hélio, em g, que foi transferida do recipiente de menor volume para o de maior volume foi mais próximo de
Dados
M (H2 ) = 2 g mol-1 .
R = 0,082 atm L mol-1 K-1
1 m3
= 1000 L
Na equação química abaixo, observa-se a representação da reação do hidrocarboneto insaturado na presença de permanganato de potássio (KMnO4 ), em meio ácido e sob aquecimento, produzindo dois produtos.
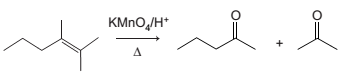
A reação do hidrocarboneto é de
A deltametrina representada na Figura abaixo, é o princípio ativo de carrapaticidas comerciais de uso veterinário.
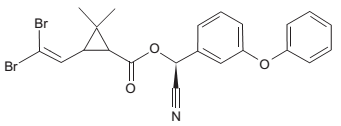
Na estrutura da deltametrina está presente, entre outras,
a função orgânica
O hidrocarboneto de fórmula C8H8 é usado como padrão na escala de octanagem para as gasolinas. A estrutura desse hidrocarboneto está representada, na forma de bastão, a seguir:
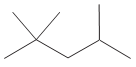
Segundo as regras da IUPAC (União Internacional de
Química Pura e Aplicada), a nomenclatura oficial desse
alcano é
O captopril, cuja estrutura está representada a seguir, é um medicamento usado para o controle da pressão arterial.
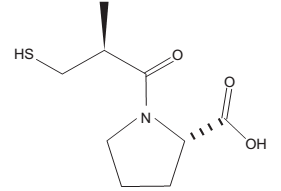
Sobre o captopril, verifica-se que ele
A reação representada na equação abaixo é lenta e reversível, mas seu rendimento é melhorado com a adição de quantidades catalíticas de ácido sulfúrico.
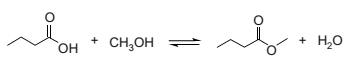
Nessa reação,
O rótulo de um frasco de solução de ácido nítrico concentrado (com 65% de HNO3 m/m) indica que 1,0 L tem massa igual a 1,4 kg. Deseja-se preparar 250 mL de uma solução 3,0 mol L-1 de HNO3 , com apenas uma etapa de diluição do ácido concentrado com água pura.
Para tal preparação, o volume aproximado de ácido necessário, em mL, é
Dados
M (HNO3
) = 63 g mol-1
O nióbio é um elemento usado para produção de aços com propriedades especiais. Na natureza, ele ocorre na forma de pentóxido de nióbio, de onde se pode obter o nióbio metálico por um processo térmico, usando uma mistura de alumínio e óxido de ferro (III), como mostrado na equação química a seguir.
3 Nb2O5(s) + Fe2O3(s) + 12 Al(s) → 6 Nb(s) + 2 Fe(s) + 6 Al2O3(s)
O processo térmico em questão produz o nióbio metálico com rendimento de 80%.
O valor aproximado da massa de Nb, em tonelada, que seria obtida a partir de 1,6 toneladas de Nb2O5 é
Dados
M (Nb) = 93 g mol-1
M (Nb2O5
) = 266 g mol-1
Uma mistura ácida é feita com 100,00 mL de solução aquosa 1,00 mol L-1 de HCℓ e 250,00 mL de solução aquosa 2,00 mol L-1 de HNO3 , ajustado, com água, o volume final para 1,0 L. Uma alíquota de 100,00 mL dessa mistura de ácidos foi coletada e neutralizada com solução 0,50 mol L-1 de NaOH.
O volume, em mL, da solução de base forte que foi necessário para promover a neutralização foi
Um volume igual a 25,00 mL de solução aquosa 1,0 x 10-2 mol L-1 de um pesticida foi transferido para um balão volumétrico que teve seu volume ajustado, com água, para 100,00 mL. Dessa solução, 20,00 mL foram coletados e passados numa coluna de extração em fase sólida onde o pesticida foi totalmente retido. Utilizaram-se 5 mL de solvente adequado para eluir 90,0% do pesticida (em mol) para um balão volumétrico onde se ajustou o volume para 10,00 mL. A fração complementar de 10,0% ficou retida na coluna sem chance de recuperação.
A concentração, em mol L-1 , do pesticida no balão de 10,00 mL é
O equilíbrio de dissociação da água é mostrado na equação de equilíbrio a seguir:
H2O ⇋ H+ + OH-
A 25°C, a constante de equilíbrio (Kw) é dada por:
Kw = [H+] [OH- ] = 1,0 x 10-14
Ao se misturarem 50 mL de uma solução aquosa do ácido
forte HCℓ (0,01 mol L-1
) com 20 mL de solução aquosa da
base forte KOH (0,02 mol L-1
) e água suficiente para se
levar o volume final a 100 mL, o pH da solução resultante,
a 25°C, será
O acetaldeído ou etanal é um aldeído que se decompõe segundo a equação abaixo:
CH3 CHO(g) → CH4(g) + CO (g)
A reação tem cinética de segunda ordem, e o valor da constante de velocidade, numa dada temperatura, é 9,0 × 10-5 L mol-1 s-1 .
O valor mais próximo da velocidade inicial de decomposição de 200 g de acetaldeído, dentro de um reator de 10 L, é
Dado
M(CH3
CHO) = 44 gmol-1
Uma mistura gasosa denominada de ARGOMETA P10 contém 10%, em massa, de metano e argônio em quantidade para fechar o balanço da composição. Considere que um recipiente, de volume igual a 100 L, está preenchido somente com 100 g de ARGOMETA P10.
Considerando condições ideais, a pressão parcial do metano no recipiente, em atm e a 298 K, é, aproximadamente, igual à
Dados
M (CH4 ) = 16 g mol-1
M (Ar) = 40 g mol-1
R = 0,082 atm L mol-1
K-1
Uma amostra de minério (5,00 g) foi completamente dissolvida em ácido e o volume ajustado para 100,00 mL. Uma alíquota de 10,00 mL dessa solução aquosa foi misturada, de forma lenta e sob agitação constante, com excesso de solução aquosa de hidróxido de amônio, suficiente para promover a precipitação completa de ferro na forma de Fe(OH)3 .
Fe3+ (aq) + 3OH- (aq) → Fe(OH)3 (s)
Após envelhecer, em sua água mãe, filtrar e lavar, o precipitado foi calcinado em forno mufla para formar Fe2O3 , que depois foi deixado para resfriar, em dessecador, até massa constante.
2 Fe(OH)3(s) → Fe2O3(s) + 3H2O(g)
Sendo a massa de Fe2O3(s), obtida após a calcinação, igual a 3,84 g, o valor mais próximo da percentagem (massa/ massa) de ferro no minério é
Dado
M (Fe) = 56 g mol-1
M (Fe2O3
) = 160 g mol-1
O cloreto de potássio (KCℓ), um sal muito solúvel em água, é derivado de um ácido forte. Sobre o cloreto de potássio e sua solução aquosa, fazem-se as seguintes afirmações:
I - O cloreto de potássio é um sal derivado de base forte.
II - O cloreto de potássio não se dissocia quando colocado em água.
III - Numa solução aquosa de cloreto de potássio tem-se [OH- ] = [H+].
Está correto o que se afirma em:
O sal, contido em uma amostra de petróleo, foi extraído em água por meio de uma extração líquido-líquido. A solução aquosa obtida (em que o único sal dissolvido era o NaCℓ) foi diluída para 1000 mL com água, formando a denominada solução de amostra salina. Um volume de 100 mL desta solução foi adicionado a uma célula de um sistema de titulação coulométrica, contendo 500 mL de água, onde se manteve contínua agitação da solução com barra magnética. No anodo de prata da célula, a reação, representada abaixo, ocorre de forma completa por conta da aplicação de uma diferença de potencial.
Ag(s) + Cℓ-(aq) → AgCℓ(s) + e
A carga total envolvida na reação foi calculada a partir do gráfico.
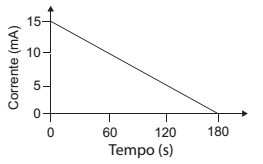
A concentração, em mol L-1 , de cloreto de sódio na solução de amostra salina era
Dado
A carga de 1 mol de elétrons é 96.500 C
Um volume igual a 2,00 mL de uma amostra de ácido muriático (ácido clorídrico comercial) foi transferido para um balão volumétrico e diluído, com água destilada, até o volume de 250,00 mL. Com auxílio de pipeta volumétrica, transferiu-se uma alíquota de 25,00 mL para um frasco Erlenmeyer contendo 100 mL de água. Essa alíquota foi titulada com solução aquosa padronizada de NaOH (0,100 mol L-1 ), e o ponto final, detectado com o indicador apropriado, foi atingido com 21,00 mL.
Nessas condições, a concentração, em mol L-1 , de HCℓ no ácido comercial é
As cromatografias líquida e gasosa são importantes técnicas analíticas que permitem a análise de amostras contendo várias espécies químicas.
Em um cromatograma típico, apresenta-se