Questões de Concurso Público Petrobras 2018 para Técnico Químico de Petróleo Júnior
Foram encontradas 12 questões
Um sal possui várias características.
NÃO constitui uma dessas características
O rótulo de um frasco de solução de ácido nítrico concentrado (com 65% de HNO3 m/m) indica que 1,0 L tem massa igual a 1,4 kg. Deseja-se preparar 250 mL de uma solução 3,0 mol L-1 de HNO3 , com apenas uma etapa de diluição do ácido concentrado com água pura.
Para tal preparação, o volume aproximado de ácido necessário, em mL, é
Dados
M (HNO3
) = 63 g mol-1
Uma mistura ácida é feita com 100,00 mL de solução aquosa 1,00 mol L-1 de HCℓ e 250,00 mL de solução aquosa 2,00 mol L-1 de HNO3 , ajustado, com água, o volume final para 1,0 L. Uma alíquota de 100,00 mL dessa mistura de ácidos foi coletada e neutralizada com solução 0,50 mol L-1 de NaOH.
O volume, em mL, da solução de base forte que foi necessário para promover a neutralização foi
Um volume igual a 25,00 mL de solução aquosa 1,0 x 10-2 mol L-1 de um pesticida foi transferido para um balão volumétrico que teve seu volume ajustado, com água, para 100,00 mL. Dessa solução, 20,00 mL foram coletados e passados numa coluna de extração em fase sólida onde o pesticida foi totalmente retido. Utilizaram-se 5 mL de solvente adequado para eluir 90,0% do pesticida (em mol) para um balão volumétrico onde se ajustou o volume para 10,00 mL. A fração complementar de 10,0% ficou retida na coluna sem chance de recuperação.
A concentração, em mol L-1 , do pesticida no balão de 10,00 mL é
O cloreto de potássio (KCℓ), um sal muito solúvel em água, é derivado de um ácido forte. Sobre o cloreto de potássio e sua solução aquosa, fazem-se as seguintes afirmações:
I - O cloreto de potássio é um sal derivado de base forte.
II - O cloreto de potássio não se dissocia quando colocado em água.
III - Numa solução aquosa de cloreto de potássio tem-se [OH- ] = [H+].
Está correto o que se afirma em:
O sal, contido em uma amostra de petróleo, foi extraído em água por meio de uma extração líquido-líquido. A solução aquosa obtida (em que o único sal dissolvido era o NaCℓ) foi diluída para 1000 mL com água, formando a denominada solução de amostra salina. Um volume de 100 mL desta solução foi adicionado a uma célula de um sistema de titulação coulométrica, contendo 500 mL de água, onde se manteve contínua agitação da solução com barra magnética. No anodo de prata da célula, a reação, representada abaixo, ocorre de forma completa por conta da aplicação de uma diferença de potencial.
Ag(s) + Cℓ-(aq) → AgCℓ(s) + e
A carga total envolvida na reação foi calculada a partir do gráfico.
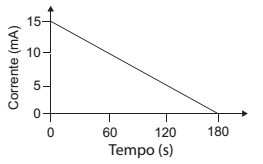
A concentração, em mol L-1 , de cloreto de sódio na solução de amostra salina era
Dado
A carga de 1 mol de elétrons é 96.500 C
Um volume igual a 2,00 mL de uma amostra de ácido muriático (ácido clorídrico comercial) foi transferido para um balão volumétrico e diluído, com água destilada, até o volume de 250,00 mL. Com auxílio de pipeta volumétrica, transferiu-se uma alíquota de 25,00 mL para um frasco Erlenmeyer contendo 100 mL de água. Essa alíquota foi titulada com solução aquosa padronizada de NaOH (0,100 mol L-1 ), e o ponto final, detectado com o indicador apropriado, foi atingido com 21,00 mL.
Nessas condições, a concentração, em mol L-1 , de HCℓ no ácido comercial é
A reação representada abaixo é a titulação potenciométrica de Cr2+ com solução padrão de Ce4+, usando um eletrodo indicador de Pt.
Cr2+ + Ce4+ → Cr3+ + Ce3+
Antes do ponto de equivalência, quando a concentração de Cr2+ é 100 vezes maior que a de Cr3+, o potencial medido, em V (numa temperatura T em que RT/F = 0,06 V), é
Dados
Potenciais em relação ao eletrodo padrão de hidrogênio.
Cr3+ + e → Cr2+ Eo = - 0,41 V
Ce4+ + e → Ce3+ Eo
= +1,44 V
A determinação de glicose foi feita em quatro réplicas, isto é, n = 4, em uma amostra coletada em jejum. Os seguintes resultados foram obtidos: 91,0 mg dL-1 ; 95,0 mg dL-1 ; 96,0 mg dL-1 e 98,0 mg dL-1 , com desvio padrão 2,9 mg dL-1 . A distribuição dos dados tende à normalidade (com t = 3,2 para 3 graus de liberdade e com 95% de limite de confiança).
Considerando o valor médio e o intervalo de confiança do resultado, o valor mais próximo, em mg dL-1 , da maior concentração admitida para glicose na amostra é
Uma solução ideal foi feita misturando 360,00 mL de água e 1 mol de um soluto não volátil, armazenando a mesma a 20°C.
O valor aproximado da pressão de vapor, em mmHg, da mistura é
Dados
Pressão de vapor da água pura: 18 mmHg a 20°C
Massa específica da água pura: 1,00 g mL-1
M (H2O) = 18,00 g mol-1
Uma solução de álcool desinfetante foi preparada, a 20°C, com água e etanol, sendo que a quantidade desse último na mistura foi de 71,2% massa/massa. O valor aproximado da pressão de vapor da mistura, em mmHg, é
Dados
Pressão de vapor do etanol puro: 44 mmHg a 20°C
Pressão de vapor da água pura: 18 mmHg a 20°C
M (água) = 18,00 g mol-1
M (etanol) = 46 g mol-1
Uma solução de NaCℓ foi feita dissolvendo, totalmente, 0,100 g do sal em água antes de transferir essa mistura para um balão volumétrico de 100,00 mL onde a solução teve seu volume ajustado. A incerteza da massa de NaCℓ é 0,001 g (calculada considerando duas etapas: a tara e a pesagem propriamente dita do sal), e a incerteza do balão é 0,10 mL.
Assim, essa solução teria uma incerteza de concentração, em gL-1 , de