Questões de Concurso Público Transpetro 2018 para Técnico de Operação Júnior
Foram encontradas 16 questões
O modelo atômico clássico que conhecemos é fundamentado nos modelos desenvolvidos nos séculos XIX e XX, em que foi possível determinar a presença dos prótons, nêutrons e elétrons.
Sendo assim, o modelo que demonstrou, teórica e praticamente, a estrutura que conhecemos atualmente foi o modelo de
Alguns ácidos do elemento enxofre são: ácido sulfuroso, ácido tiossulfúrico, ácido sulfídrico e ácido sulfúrico.
As fórmulas químicas desses ácidos estão, respectivamente, apresentadas em:
A configuração eletrônica define, em grande parte, as propriedades químicas dos elementos.
O tálio é um elemento metálico e representativo, que tem configuração eletrônica terminada com elétrons nos orbitais:
Um mol de gás hélio (He) e um mol de gás carbônico (CO2) são encerrados em um vaso rígido de 10,0 L. Nesse sistema gasoso, considerando condições ideais, tem-se que
Dado
M (He) = 2 g mol-1
M (CO2
) = 44 g mol-1
A espermina é uma substância que é encontrada no fluido seminal e está representada abaixo.
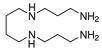
Na estrutura dessa molécula, tem-se o seguinte:
O alumínio reage de forma bastante energética quando colocado em solução aquosa concentrada de NaOH, produzindo um precipitado, o tetrahidroxialuminato de sódio, e gás hidrogênio, conforme se explicita na equação química a seguir.
2 Aℓ (s) + 2 NaOH (aq) + 6 H2 O (l) → 2 NaAℓ(OH)4 (s) + 3 H2 (g)
O rendimento percentual da reação é de 90%. A partir de 81,0 g de alumínio em pó, adicionado em meio aquoso onde se garante excesso de NaOH, o volume de gás, em litros, produzido (considerando-se 1 atm de pressão, a 298 K e comportamento ideal) é mais próximo de
Dado
M (H2 ) = 2 g mol-1
M (Aℓ) = 27 g mol-1
R = 0,082 atm L mol-1 K-1
R × T = 24,4 atm L mol-1
Uma solução é definida por ser uma mistura homogênea de duas ou mais substâncias.
Nesse sentido, as duas misturas a seguir são consideradas homogêneas:
Uma solução salina foi preparada pela dissolução completa de 0,71 g de Na2 SO4 e 1,17 g de NaCℓ, tendo o volume final ajustado, com água destilada, para 250,00 mL num balão volumétrico.
A concentração, em mol L-1 , do íon sódio na solução é
Dado
M (Na2 SO4 ) = 142,0 g mol-1
M (NaCℓ) = 58,5 g mol-1
A estrutura química de um hidrocarboneto é representada abaixo:
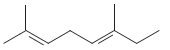
A cadeia carbônica desse hidrocarboneto é
A carbonila é um grupo funcional constituído de um átomo de carbono e um de oxigênio que são ligados por ligação dupla. A carbonila entra na composição de várias classes de compostos orgânicos.
A classe de compostos orgânicos que tem o carbono sp2 da carbonila ligado, por ligação simples, a radicais derivados de hidrocarboneto é
A água é a molécula responsável pela vida no planeta Terra. A molécula de água tem duas ligações simples e geometria angular.
Sobre a molécula da água, tem-se que as ligações
A reação a seguir é muito útil em procedimentos para determinação do teor de ferro.
SnCℓ2 (aq) + 2 FeCℓ3 (aq) → SnCℓ4 (aq) + 2 FeCℓ2 (aq)
Sobre essa reação, na direção da formação dos produtos, tem-se que
Dado
Eº (Fe3+/Fe2+) = +0,77 V
Eº (Sn4+/Sn2+) = +0,15 V
A combustão do etanol produz calor por conta da variação de entalpia (ΔH) de reação, como indicado na equação a seguir:
C2H5OH (ℓ) + 3O2 (g) → 2CO2 (g) + 3H2O (g) ΔH = - 327 kcal
Sabendo-se que a densidade do etanol é 0,80 g mL-1 , e considerando-se combustão completa, pressão constante e um calor liberado de 9810 kJ, o volume, em litros, de etanol que reagiu foi
Dado
M (C2H5OH) = 46 g mol-1
A reação química representada a seguir corresponde à combustão do etanol a 20 °C:
C2 H6 O (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2 O (g)
Três grandezas termodinâmicas associadas à essa reação são:
ΔH = variação de entalpia
ΔS = variação de entropia
ΔG = variação da energia livre de Gibbs
Analisando-se a reação em relação a essas grandezas, constata-se que