Questões de Concurso Público UNIRIO 2019 para Técnico de Laboratório - Química
Foram encontradas 30 questões
Uma mistura homogênea é formada por dois líquidos que apresentam diferentes temperaturas de ebulição.
O processo indicado para separar os componentes dessa mistura é denominado
Ao se borbulhar um óxido em uma solução aquosa de hidróxido de bário, observa-se a formação de um precipitado de carbonato de bário.
A fórmula química do óxido corresponde a
O óxido de zinco é um composto anfótero, reagindo tanto com ácidos fortes quanto com bases fortes.
O produto formado na reação do óxido de zinco com hidróxido de sódio tem a seguinte fórmula química:
A reação química entre soluções aquosas de  e
NaOH acarreta a formação de um produto com aroma característico.
e
NaOH acarreta a formação de um produto com aroma característico.
Esse produto corresponde a
Uma amostra é formada apenas por HCl no estado líquido.
Nessa amostra, a interação entre as moléculas corresponde à ligação
Em uma unidade industrial, é feita a seguinte reação química:
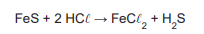
Nessa unidade, adicionaram-se 440 kg de FeS e 146 kg
de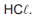
Admitindo-se que o reagente limitante foi totalmente consumido, a massa de reagente em excesso, em kg, que não participou da reação é igual a

Ácido sulfúrico em excesso foi adicionado a uma amostra de 150 g de alumínio metálico impuro, verificando-se a formação de 10 g de H2 , após a completa reação do alumínio.
Admitindo-se que as impurezas presentes não reagiram
com o ácido, o grau de pureza do alumínio é igual a
Em uma prática de laboratório, 1 L de solução aquosa foi obtido ao se misturar 600 mL de solução 0,010 mol/L de cloreto férrico e 400 mL de solução 0,020 mol/L de cloreto de cálcio.
Admitindo-se completa dissociação dos sais, a concentração de íons cloreto na mistura formada, em mol/L, é igual a
Uma solução aquosa de cloreto de sódio foi preparada e teve suas temperaturas de ebulição e de congelamento determinadas sob pressão de 1 atm.
Ao se interpretarem os resultados obtidos, conclui-se que a solução salina apresenta:
Em um estudo avaliou-se a velocidade da seguinte reação química:
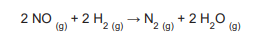
Foram realizados três experimentos distintos, nos quais se variaram as concentrações iniciais dos reagentes, conforme apresentado na Tabela a seguir.
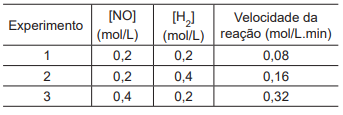
A constante cinética dessa reação química, em L2 mol-2
min-1
,
é igual a
Em um laboratório, estão disponíveis os seguintes sais:
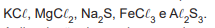
A dissolução de um desses sais em água acarretou a formação de uma solução aquosa com pH ácido.
O sal dissolvido correspondeu a
Em um experimento, avaliou-se a seguinte reação química:

As concentrações iniciais de SO2 e O2 foram 0,3 mol/L e 0,2 mol/L, respectivamente. No início da reação, não havia SO3 no reator, mas atingido o equilíbrio, sua concentração foi igual a 0,2 mol/L.
Para esse sistema, a constante de equilíbrio, em termos
de concentrações, é igual a
Deseja-se preparar 800 mL de solução aquosa de hidróxido de sódio com pH igual a 12 e a 25 °C.
Assumindo-se completa dissociação do hidróxido de sódio em solução, a massa de base necessária para o preparo da solução, em g, corresponde a
Para a realização de uma análise, é necessário o preparo
de uma solução tampão básica. Estão disponíveis os seguintes reagentes:
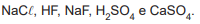
Os reagentes a serem selecionados para o preparo da solução tampão são:
O tipo de risco, ao qual um indivíduo estará exposto ao manusear um produto químico, é indicado no pictograma usado nas rotulagens. A partir dos pictogramas, o usuário é alertado para os cuidados que devem ser tomados, a fim de se evitarem acidentes. Considere que, no rótulo de um frasco, onde há uma determinada substância química, está o pictograma representado a seguir.

Esse pictograma indica que a substância é
Um técnico possui quatro tipos de placas de metal (de cobre, de zinco, de chumbo e de prata) e soluções aquosas de sulfato de cobre, de sulfato de zinco, de nitrato de chumbo e de nitrato de prata.
Uma reação química redox espontânea ocorre quando a
placa de 
O teor de mercúrio em um padrão certificado de água é 1,46 mg L-1 . Uma análise, com três réplicas, foi realizada, e os resultados obtidos, em mg L-1 , foram: 1,50, 1,52 e 1,54.
Sendo assim, o erro relativo da análise, em %, e o maior desvio obtido, em mg L-1 , são, respectivamente:
A decomposição da água é representada na reação termoquímica abaixo.
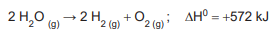
A variação de entalpia, em kJ, de formação de 1 mol de
H2
O(g) será de