Questões de Concurso Público SEDU-ES 2010 para Professor B — Ensino Fundamental e Médio — Química
Foram encontradas 48 questões
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
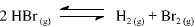
Com base nessas informações, julgue o item que se segue.
A 500 K, a constante de equilíbrio para a reação 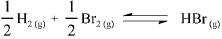 é maior que 1,0 x 104
é maior que 1,0 x 104
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
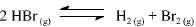
Com base nessas informações, julgue o item que se segue.
Se 0 HBr(g) for colocado em um recipiente fechado, sob
pressão inicial de 0,10 bar, e a temperatura do sistema for
elevada a 500 °C, a pressão parcial de H2(g), quando atingido o
equilíbrio, deve ser maior que 1,0 x 10-7 bar.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximos item.
O potencial elétrico mínimo (E) que deve ser aplicado à célula eletrolítica para que ocorra a eletrólise do NaCl pode ser calculado pela equação E = E (Na+/Na) + 2E (Cl2/ Cl- ) , em que E ( Na+ /Na ) e E(C12 /Cl- ) são, respectivamente, os potenciais elétricos de redução dos pares Na+/Na e Cl2/Cl- na temperatura do experimento.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
No processo, sabendo que M(Na) = 23 g/mol, a circulação de uma corrente elétrica igual a 2,0 A em um intervalo de 4.825 s deve produzir uma massa superior a 2,0 g de sódio metálico.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
A formação de 2,0 g de sódio metálico deve ser acompanhada pela formação de uma massa superior a 4,0 g de Cl2.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
A partir da localização do N a e do K na tabela periódica, é correto concluir que a eletrólise do KC1 requer a aplicação de um potencial elétrico maior que aquele requerido para a eletrólise do NaCl.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
Na produção do sódio metálico, é possível realizar a eletrólise do NaCl na forma sólida.
Considerando a constante de Faraday igual a 96.500 C/mol e as informações apresentadas acima, julgue o próximo item.
Os mesmos produtos produzidos na eletrólise do NaCl puro são obtidos na eletrólise de uma solução aquosa de NaCl.