Questões de Concurso Público SEDU-ES 2010 para Professor B — Ensino Fundamental e Médio — Química
Foram encontradas 5 questões
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
A molécula de NH3 é apoiar e apresenta geometria trigonal
plana.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
A polaridade da ligação H— X, em que X corresponde a um
halogênio, é maior no HC1 que no HBr.
Considere as seguintes entalpias padrões, 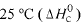
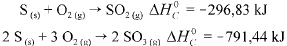
Com base nessas informações, julgue o item que se segue.
A molécula de SO2 é apoiar, enquanto a de SO3 é polar
Visando adequar-se aos conceitos de síntese limpa, a indústria química tem procurado substituir antigas rotas sintéticas por outras que possibilitem minimizar a geração de resíduos e os riscos ambientais a eles associados. Um exemplo disso é o processo industrial desenvolvido para a síntese do analgésico ibuprofeno, da Hoechst-Celanese, a partir do composto X representado no esquema da figura a seguir. Esse processo é com posto de três etapas, apresenta reduzido emprego de solventes e resulta em uma utilização atômica de cerca de 77%. Tal processo representou considerável avanço em relação à rota clássica, da companhia Boots, também mostrado na figura, que possui 6 etapas e uma pobre utilização atômica, além de requerer o uso de elevadas quantidades de solvente e provocar geração de sais residuais.

Considerando as rotas sintéticas apresentadas no texto, suas reações e com postos envolvidos, julgue os itens de 89 a 103.
No com posto A5 é possível identificar átomos de carbono com
as ligações orientadas segundo os vértices de um tetraedro, de
um triângulo e, também, orientadas a 180° (linearmente).
A reação abaixo representa a formação do íon acílio, por meio da ação do catalisador A1C13, durante uma reação de acilação de Fiedel-Crafts (etapa 1 da rota de Boots apresentada no texto).

A respeito do mecanismo apresentado e das espécies envolvidas, julgue o item subsequente.
O A1C13 apresenta três ligações covalentes polares e a
molécula, como um todo, é apoiar.