Questões de Concurso Público SEDUC-CE 2013 para Professor Pleno I - Química
Foram encontradas 80 questões
Em 1930, o neutrino foi proposto, pelo físico alemão Wolfgang Pauli, como uma tentativa teórica para explicar os fenômenos observados no decaimento beta, que, como se sabe atualmente, consiste na desintegração do nêutron no núcleo atômico. A confirmação experimental da proposta ocorreu em 1956, pelos físicos americanos Clyde Cowan e Frederico Reines, que, pelo feito, foram laureados com o prêmio Nobel de 1995.
J. L. Ferreira e A. E. Santana. Física na Escola. n.º 7, 2006, p. 41 (com adaptações).
Com base no texto, é correto afirmar que a evidência experimental da existência do neutrino reforça a concepção
Por meio do efeito Joule-Thomson, descreve-se a variação de temperatura de um gás, mantido isolado e em condições adiabáticas, ao ser forçado a passar através de uma válvula. Dependendo da temperatura e da natureza do gás, esse efeito pode resultar em aquecimento ou resfriamento, o que pode ser previsto mediante os valores do coeficiente de Joule-Thomson (μJT) e da temperatura de inversão do gás. O gráfico a seguir esboça a dependência de μJT com a temperatura para o gás hidrogênio.
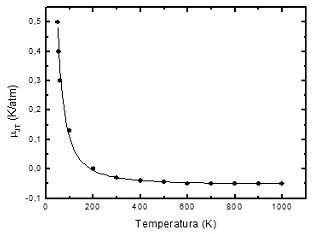
Nesse sentido, é correto afirmar que o hidrogênio, ao passar pela
válvula de uma câmara à alta pressão para outra câmara à pressão
atmosférica a 25 °C, sofrerá
A osmose é a passagem de solvente através de uma membrana semipermeável de um meio para outro meio mais concentrado. Para evitar a osmose e garantir o equilíbrio entre os meios, é necessária a aplicação de uma pressão π (pressão osmótica) no meio mais concentrado. Considere o esquema a seguir, em que volumes iguais de água destilada e de determinada solução aquosa estejam separados por uma membrana porosa permeável ao solvente. Considere, ainda, que foram medidos os valores de pressão osmótica de três soluções aquosas distintas: 1) CH3COOH(aq) 0,010 mol/L; 2) NaOH(aq) 0,010 mol/L e 3) CaCl2(aq) 0,008 mol/L.
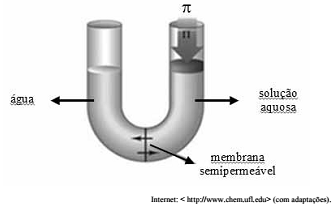
Com base nessas informações e supondo que as soluções
comportem-se idealmente, a ordem crescente das pressões
osmóticas medidas corresponde a
Considerando-se o equilíbrio químico
NH+4(aq) + H2O(l) ⇄ H3O +(aq) + NH3(aq),
em que a constante de equilíbrio é igual a 5,6 × 10-10, é correto afirmar que o valor mais próximo para o pH de uma solução 0,15 mol/L de NH4Cl(aq) é
Ao organizar uma bancada, um professor derrubou acidentalmente uma solução alcoólica de fenolftaleína. Após jogar detergente, com o intuito de limpar a bancada, o professor notou que a parte molhada com fenolftaleína tornou-se rosa.
Em face dessa situação, é correto concluir que o detergente
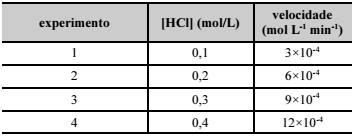
Considerando a tabela acima, que apresenta os valores de
concentração de HCl e das velocidades de decomposição do gás
cloreto de hidrogênio obtidos experimentalmente, conforme reação
elementar 2HCl(g) → H2(g) + Cl2(g), e que não houve variação de
temperatura, assinale a opção que apresenta a constante de
velocidade característica dessa reação.
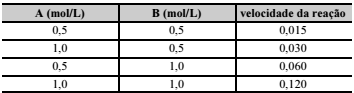
De acordo com a lei da ação das massas, a velocidade de uma reação é diretamente proporcional ao produto das concentrações molares dos reagentes. Assim, para a reação aA + bB ⇄ cC + dD, a equação da velocidade é V = K·[A]a ·[B]b . Considerando essas informações e que, na tabela acima, são apresentados resultados experimentais para essa mesma reação, assinale a opção correta.