Questões de Concurso Público SEE-AL 2013 para Professor - Química
Foram encontradas 120 questões
A descoberta do nêutron, por Chadwick, tornou-se possível com a seguinte reação de transmutação: x + 4Be9 → 6C12 + 0 n1 em que x representa uma partícula β
A radiação γ apresenta elevado poder de penetração na pele, podendo, por isso, causar danos celulares
O urânio é um dos elementos radioativos utilizados nas usinas nucleares e na fabricação das bombas atômicas. A fissão nuclear do urânio é representada pela seguinte equação: 92U235 + 0n1 → 56Ba138 + 36Kr86 +10 0n1 .
Sabendo-se que o urânio-238 tem período de meia-vida de 8.766 horas, é correto afirmar que sua vida média é de aproximadamente 1,27.104 horas
O carbono constitui toda matéria orgânica, havendo, nos seres vivos, uma razão entre a quantidade de carbono-14 — isótopo radioativo — e de carbono-12, de modo que, quando o organismo morre, a relação entre carbono-14 e carbono-12 decresce.
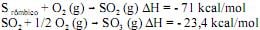
Considerando essas equações químicas, julgue os itens seguintes.
A reação global pode ser representada pela seguinte equação:
S rômbico + 3/2 O2 (g) → SO3 (g) ΔH = -94,4 kcal/mol.
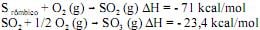
Considerando essas equações químicas, julgue os itens seguintes.
A entropia da reação global aumentou porque seu ΔH é mais negativo que os ΔH das etapas da reação.
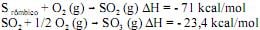
Considerando essas equações químicas, julgue os itens seguintes.
Para um processo que ocorre sob temperatura constante, a energia livre de Gibbs pode ser calculada por ΔG = ΔH - T ΔS.
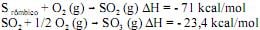
Considerando essas equações químicas, julgue os itens seguintes.
As reações de formação dos óxidos de enxofre são endotérmicas.

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Considerando-se que o ar atmosférico que respiramos seja composto por CO2, O2, N2 e H2O, com 20,9% de O2, e que, no nível do mar, a pressão atmosférica seja de 760 mmHg, é correto afirmar que a pressão parcial exercida pelo O2 é de 0,209 atm.

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Sabendo-se que a densidade dos gases pode ser definida pela sua massa molar e considerando-se que M(C) = 12 g/mol, M (O) = 16 g/mol, M (H) = 1 g/mol, M (Ar) = 40 g/mol e M(N) = 14 g/mol e que a composição do ar em volume seja de 78% de N2, 21% de O2 e 1% de Ar, é correto afirmar que os gases CO2, NH3 e CH4 são mais densos que o ar atmosférico

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
A transformação isotérmica é definida pela Lei de Boyle, segundo a qual o volume e pressão são inversamente proporcionais, mesmo quando ocorre variação na quantidade de matéria.

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Sabendo-se que, em um cilindro, haja 7,66 kg de gás oxigênio a uma pressão de 300 bar a 25 °C e considerando-se que R = 0,082 atm.L/mol. K, M (O) = 16 g/mol, 0 °C = 273 K e 1 bar = 0,987 atm, é correto afirmar que o volume desse cilindro é de 30 litros.

A partir das informações contidas no fragmento de texto acima, julgue os itens que se seguem.
Considerando-se uma massa fixa de gás com volume constante, é correto afirmar que o aumento da temperatura aumenta a velocidade média das moléculas e, consequentemente, o número de colisões.
Na pilha de Daniell, o zinco oxida no cátodo, polo positivo da pilha.
Os experimentos de Alessandro Volta impulsionaram o estudo das pilhas, tendo ele montado a primeira pilha voltaica.
A pilha de Daniell é representada pelo seguinte diagrama de célula:

A ionização do ácido sulfídrico (H2S), constituído de dois hidrogênios ionizáveis, ocorre em duas etapas e apresenta duas constantes de ionização que têm o mesmo valor.
O ácido acético (HC2H3O2), um dos principais componentes do vinagre, apresenta Ka = 1,8.10 -5 , sendo, por isso, classificado em ácido fraco, embora sua base conjugada C2H3O- 2 seja forte.
Quanto maior for o valor da constante de ionização básica, maior será o valor do pH.