Questões de Concurso Público FUB 2014 para Técnico de Laboratório - Química
Foram encontradas 65 questões
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

O cloreto férrico aumenta a energia de ativação da reação, de forma que maior fração das moléculas de água oxigenada terá energia suficiente para ativar a reação.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

De acordo com o gráfico apresentado, a reação em questão é uma reação de primeira ordem em relação à concentração da água oxigenada.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

Considerando-se condições em que o tempo de meia-vida da água oxigenada seja igual a 2 anos, é correto afirmar que em um período de 8 anos haverá a decomposição de mais de 90% da quantidade inicial de água oxigenada contida em uma solução.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

Considerando o comportamento ideal para o gás, a decomposição completa de 17,0 g de água oxigenada em H2O( l ) e O2 (g) libera um volume de O2(g), medido nas CNTP, superior a 5,0 L.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

A equação da reação de oxirredução da água oxigenada com permanganato de potássio em meio ácido mostrada a seguir está corretamente balanceada.
MnO4 - ( aq) + H2O2 (aq) + 2H+(aq ) → Mn 2+ ( aq) + 2H2O( l ) + 2O2(g).
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

O manganês é um metal de transição externa do quarto período da tabela periódica. O número de oxidação máximo que ele assume ao se combinar com outros elementos para formar compostos é igual a +7.
Com base na situação hipotética apresentada, julgue os itens que se seguem, considerando que a solução estoque de HCl, aquosa, apresenta densidade igual a 1,19 g/mL e concentração percentual em massa igual a 37,0%.
No procedimento de titulação, a solução titulante deve ser adicionada lentamente à solução titulada por meio de uma pipeta volumétrica.
Com base na situação hipotética apresentada, julgue os itens que se seguem, considerando que a solução estoque de HCl, aquosa, apresenta densidade igual a 1,19 g/mL e concentração percentual em massa igual a 37,0%.
Para preparar 1.000 mL de uma solução aquosa de HCl 0,100 mol/L, será necessário utilizar um volume da solução estoque de HCl superior a 10,0 mL
Com base na situação hipotética apresentada, julgue os itens que se seguem, considerando que a solução estoque de HCl, aquosa, apresenta densidade igual a 1,19 g/mL e concentração percentual em massa igual a 37,0%.
Uma solução de HCl preparada a partir de uma solução estoque comercial deve ser padronizada por meio da titulação com uma solução padrão básica antes de ser utilizada como solução padrão ácida.
da solução de titulante.
Com base na situação hipotética apresentada, julgue os itens que se seguem, considerando que a solução estoque de HCl, aquosa, apresenta densidade igual a 1,19 g/mL e concentração percentual em massa igual a 37,0%.
O ácido clorídrico, por ser um ácido fraco, dispensa o cuidado de ser manuseado em capela.
Com base na situação hipotética apresentada, julgue os itens que se seguem, considerando que a solução estoque de HCl, aquosa, apresenta densidade igual a 1,19 g/mL e concentração percentual em massa igual a 37,0%.
É aconselhável que seja provocado vômito em pessoa que tenha ingerido HCl ou outro ácido concentrado.
Com base na situação hipotética apresentada, julgue os itens que se seguem, considerando que a solução estoque de HCl, aquosa, apresenta densidade igual a 1,19 g/mL e concentração percentual em massa igual a 37,0%.
No caso de queimaduras na pele causadas com bases fortes, como Ba(OH)2, recomenda-se lavar o local com bastante água, em seguida lavar com uma solução diluída de ácido acético e, por fim, novamente com água
A determinação da massa molar média de uma amostra de poliestireno pode ser feita por meio da cromatografia de permeação em gel (GPC), um tipo de cromatografia líquida. Como detector, emprega-se usualmente um detector espectrofotométrico operando a um comprimento de onda igual a 254 nm (faixa do ultravioleta).
Considerando as informações apresentadas, julgue os itens seguintes.
Além da massa molar média, as análises de GPC permitem avaliar o grau de polidispersão em massa de uma amostra polimérica.

A determinação da massa molar média de uma amostra de poliestireno pode ser feita por meio da cromatografia de permeação em gel (GPC), um tipo de cromatografia líquida. Como detector, emprega-se usualmente um detector espectrofotométrico operando a um comprimento de onda igual a 254 nm (faixa do ultravioleta).
Considerando as informações apresentadas, julgue os itens seguintes.
A água oxigenada pode ser armazenada em frascos de polietileno, que também são adequados para o armazenamento de hidrocarbonetos líquidos, como o benzeno e o hexano.

A determinação da massa molar média de uma amostra de poliestireno pode ser feita por meio da cromatografia de permeação em gel (GPC), um tipo de cromatografia líquida. Como detector, emprega-se usualmente um detector espectrofotométrico operando a um comprimento de onda igual a 254 nm (faixa do ultravioleta).
Considerando as informações apresentadas, julgue os itens seguintes.
Na técnica de cromatografia líquida, além do detector espectrofotométrico, é usual também o emprego de detectores de ionização de chama.

A determinação da massa molar média de uma amostra de poliestireno pode ser feita por meio da cromatografia de permeação em gel (GPC), um tipo de cromatografia líquida. Como detector, emprega-se usualmente um detector espectrofotométrico operando a um comprimento de onda igual a 254 nm (faixa do ultravioleta).
Considerando as informações apresentadas, julgue os itens seguintes.
Para instrumentos como o espectrofotômetro, que opera na faixa do ultravioleta, deve-se utilizar cubetas de vidro, pois, as de plástico absorvem esse tipo de radiação.

A determinação da massa molar média de uma amostra de poliestireno pode ser feita por meio da cromatografia de permeação em gel (GPC), um tipo de cromatografia líquida. Como detector, emprega-se usualmente um detector espectrofotométrico operando a um comprimento de onda igual a 254 nm (faixa do ultravioleta).
Considerando as informações apresentadas, julgue os itens seguintes.
O procedimento analítico mais indicado para o preparo de uma solução 3,0 % em massa de água oxigenada, a partir da solução estoque citada, é medir 10 mL dessa solução estoque em uma proveta e adicionar 90 mL de água, também medidos com o auxílio de uma proveta.

A determinação da massa molar média de uma amostra de poliestireno pode ser feita por meio da cromatografia de permeação em gel (GPC), um tipo de cromatografia líquida. Como detector, emprega-se usualmente um detector espectrofotométrico operando a um comprimento de onda igual a 254 nm (faixa do ultravioleta).
Considerando as informações apresentadas, julgue os itens seguintes.
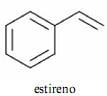
O estireno, cuja nomenclatura oficial é etenilbenzeno, é um hidrocarboneto aromático que também é usualmente chamado de vinilbenzeno.

A determinação da massa molar média de uma amostra de poliestireno pode ser feita por meio da cromatografia de permeação em gel (GPC), um tipo de cromatografia líquida. Como detector, emprega-se usualmente um detector espectrofotométrico operando a um comprimento de onda igual a 254 nm (faixa do ultravioleta).
Considerando as informações apresentadas, julgue os itens seguintes.
Na polimerização por adição, o emprego de maiores proporções do agente iniciador é indicado para a obtenção de um polímero com massa molar média mais elevada.
Na figura I, a seguir, apresenta-se um esquema da montagem usada na titulação de 50,0 mL de uma solução problema de Fe 2+ , em meio ácido, com uma solução de Ce 4+ 0,100 mol/L. O eletrodo de referência empregado é um eletrodo de calomelano cujo potencial elétrico é 0,24 V. Na figura II, apresenta-se a curva de potencial obtida. A tabela apresenta os potenciais elétricos padrão das semirreações envolvidas na reação global (Fe 2++ Ce4+→ Fe 3+ + Ce 3+ ), assim como o potencial do eletrodo padrão de hidrogênio.

O potencial elétrico padrão para a reação global de oxirredução apresentada é superior a 2,0 V.