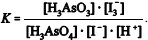Questões de Concurso Público FUB 2015 para Químico
Foram encontradas 120 questões
Quanto à mutabilidade, a doutrina majoritária classifica a CF como rígida, visto que, para a modificação do seu texto, exige-se um processo legislativo especial.
O Estado de S.Paulo, 27/6/2015, p. A21 (com adaptações).
Tendo esse fragmento de texto como referência inicial e considerando a amplitude do tema por ele abordado, bem como o contexto geopolítico no qual este se insere, julgue o item a seguir.
O Oriente Médio, onde se situa o território palestino, é região estratégica para o mundo contemporâneo desde que o petróleo passou a exercer papel relevante na economia mundial, o que explica a histórica atenção que lhe é conferida pelas grandes potências.
Ainda que sejam utilizados diferentes sistemas operacionais, no Mozilla Thunderbird é possível importar configurações e contas de emails de outros ambientes, como, por exemplo, o Outlook e o Eudora.
No MS Excel, o procedimento denominado referência absoluta possibilita que, ao se copiar, na planilha, a fórmula de uma célula para outra célula, o programa ajuste automaticamente a fórmula para que ela se adapte à nova célula.
O Outlook Express dispõe de recursos que permitem manter os emails no servidor para que os usuários possam ler suas mensagens de quaisquer lugares ou máquinas que tiverem acesso a esse servidor.
A função da autoridade certificadora é emitir certificado digital de usuários da Internet.
O phishing é um procedimento que possibilita a obtenção de dados sigilosos de usuários da Internet, em geral, por meio de falsas mensagens de email.
Os navegadores de Internet, como o Internet Explorer ou o Firefox, permitem que sejam abertas quaisquer páginas que estejam no formato de arquivo denominado .http.
As cópias de segurança do ambiente Windows podem ser feitas por meio da ferramenta de assistente de backup, a qual oferece ao usuário opções de escolha de itens para serem copiados, como, por exemplo, pastas e arquivos pessoais ou, ainda, todas as informações do computador.
Com relação à energia interna e à primeira lei da termodinâmica, julgue o item a seguir.
Um processo é considerado espontâneo quando ocorre sem a
influência externa. A entropia de um sistema isolado aumenta
durante qualquer mudança espontânea.
Com relação à energia interna e à primeira lei da termodinâmica, julgue o item a seguir.
Se, em um sistema adiabático, ocorre um processo reversível,
a variação da entropia é maior que zero.
Com relação à energia interna e à primeira lei da termodinâmica, julgue o item a seguir.
A única forma de mudar a energia interna de um sistema fechado é transferir energia para ele na forma de calor ou trabalho.
Com relação à energia interna e à primeira lei da termodinâmica, julgue o item a seguir.
Considere que um gás ideal, ocupando um volume de 2,0 L,
tenha sofrido uma transformação isobárica, a uma pressão de
1,5 atm, e tenha passado a ocupar um volume de 4,5 L,
absorvendo, nesse processo, 1.000 J de calor. Nessa situação,
a variação da energia interna do sistema é superior a 615 J.
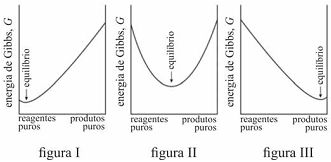
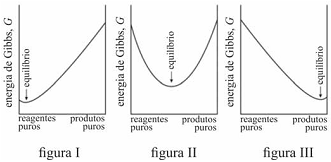
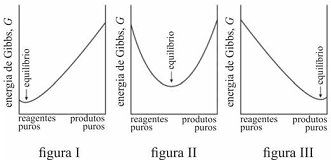
Caso G varie como apresentado no gráfico da figura III, uma
proporção alta de produtos tende a se formar antes de G
alcançar seu mínimo.
É possível prever, termodinamicamente, se os reagentes de uma mistura têm a tendência espontânea para se transformarem em produtos, se a composição, no equilíbrio, será modificada ao se alterarem as condições de um sistema, entre outros comportamentos termodinâmicos. Acerca de equilíbrio químico e considerando os gráficos representados nas figuras I, II e III, que mostram três situações de equilíbrio, julgue o item que se segue.
A reação representada no gráfico da figura II não se encontra em equilíbrio.
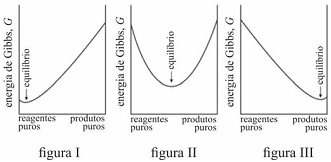
É possível prever, termodinamicamente, se os reagentes de uma mistura têm a tendência espontânea para se transformarem em produtos, se a composição, no equilíbrio, será modificada ao se alterarem as condições de um sistema, entre outros comportamentos termodinâmicos. Acerca de equilíbrio químico e considerando os gráficos representados nas figuras I, II e III, que mostram três situações de equilíbrio, julgue o item que se segue.
Em uma reação química, a variação da energia de Gibbs de
reação com a temperatura depende da entropia de reação. A
energia de Gibbs de uma reação que produz gás aumenta com
o aumento da temperatura.
É possível prever, termodinamicamente, se os reagentes de uma mistura têm a tendência espontânea para se transformarem em produtos, se a composição, no equilíbrio, será modificada ao se alterarem as condições de um sistema, entre outros comportamentos termodinâmicos. Acerca de equilíbrio químico e considerando os gráficos representados nas figuras I, II e III, que mostram três situações de equilíbrio, julgue o item que se segue.
O critério termodinâmico para uma transformação espontânea, à temperatura e à pressão constantes, é que a variação da energia de Gibbs seja maior que zero.
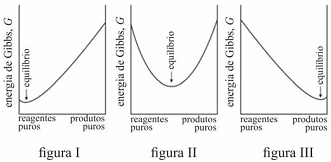
É possível prever, termodinamicamente, se os reagentes de uma mistura têm a tendência espontânea para se transformarem em produtos, se a composição, no equilíbrio, será modificada ao se alterarem as condições de um sistema, entre outros comportamentos termodinâmicos. Acerca de equilíbrio químico e considerando os gráficos representados nas figuras I, II e III, que mostram três situações de equilíbrio, julgue o item que se segue.
Na reação representada pelo gráfico da figura I, quantidades muito pequenas dos reagentes se convertem em produtos antes que G alcance seu valor mínimo e a reação se processe lentamente.
Considere que a reação química apresentada a seguir tenha ocorrido em meio aquoso, e que a velocidade dessa reação e a extensão na qual ela procede, para direita, podem ser prontamente avaliadas pela observação da cor vermelho-alaranjada do íon triiodeto I3- (os outros participantes da reação são incolores).
H3AsO4 + 3I- + 2H+ ↔ H3AsO3 + I-3 + H2O
Considerando essas informações, julgue o item subsecutivo.
Considerando a reação H3AsO3 + I-3 ↔ H3AsO4 + 3I- + 2H+ , é correto afirmar que, ao se adicionar 1 mmol de ácido arsenioso, H3AsO3, a 100 mL de uma solução, contendo 1 mmol de íon triiodeto, a solução produzida será incolor.
Considere que a reação química apresentada a seguir tenha ocorrido em meio aquoso, e que a velocidade dessa reação e a extensão na qual ela procede, para direita, podem ser prontamente avaliadas pela observação da cor vermelho-alaranjada do íon triiodeto I3- (os outros participantes da reação são incolores).
H3AsO4 + 3I- + 2H+ ↔ H3AsO3 + I-3 + H2O
Considerando essas informações, julgue o item subsecutivo.
A constante de equilíbrio da reação apresentada pode ser corretamente expressa como