Questões de Concurso Público Polícia Federal 2018 para Perito Criminal Federal - Área 6
Foram encontradas 31 questões


A partir das posições relativas dos elementos na tabela periódica, é possível inferir que um átomo neutro de ferro apresenta maior raio atômico do que um átomo neutro de manganês.


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Átomos de ferro e de manganês com números de massa iguais
a 55 e 54, respectivamente, possuem o mesmo número de
nêutrons.


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A massa molar da molécula de luminol é superior a
176,0 g/mol.


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
No ânion 3-aminoftalato, todos os átomos de carbono,
nitrogênio e oxigênio se encontram em um mesmo plano.


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A molécula de H2O2 é apolar e apresenta menor ponto de
ebulição normal do que a água.


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Na molécula do luminol, os hidrogênios do grupo NH2 ligado
ao anel aromático são mais ácidos do que os hidrogênios dos
grupos NH presentes no segundo ciclo.


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A quantidade de calor liberada por mol de moléculas de H2O2
decompostas é maior na reação realizada em presença do
catalisador do que na reação não catalisada.


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Em solução aquosa com pH igual a 10,0, o grau de ionização
ácida do H2O2 é superior a 2,0%.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


A partir do gráfico apresentado e de acordo com a equação de Arrhenius, é possível determinar que a energia de ativação da reação é superior a 1,0 × 105 J × mol-1 .
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
A curva resultante da plotagem do logaritmo neperiano da
concentração do H2O2 em função do tempo de reação resulta
em uma reta com inclinação negativa.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
O tempo necessário para que a concentração de H2O2 caia a
10% do valor inicial equivale a 10 × ek
, em que k é a constante
de velocidade da reação de decomposição do H2O2.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
O fato de a reação de decomposição do H2O2 ser de primeira
ordem implica tratar-se de uma reação elementar.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
Em temperaturas mais elevadas, o valor da constante de
equilíbrio da reação de decomposição do H2O2 é superior ao
verificado em temperaturas mais baixas.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
A reação de decomposição do H2O2 libera maior quantidade de calor quando é realizada à pressão constante de 1 bar do que quando é realizada a volume constante.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
As entalpias padrão de ligação fornecidas permitem determinar que a decomposição de 1,00 mol de H2O2, quando realizada à pressão constante de 1 bar e a 25 ºC, libera quantidade de calor superior a 100 kJ.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
A constante de equilíbrio da reação de decomposição de 1 mol
de H2O2, a 25 ºC, é superior a e50.

A figura precedente mostra o gráfico do coeficiente de compressibilidade (Z) dos gases O2 e CO2 em função da pressão para a temperatura T2. Considerando a situação hipotética apresentada e as informações fornecidas, que a constante universal dos gases seja igual a 0,082 atm × L × mol-1 × K-1 , que a 300 K e 1,00 atm o O2 (g) e o CO2 (g) apresentem comportamento de gás ideal, e que a 300 atm e a uma temperatura T2 o O2 (g) e o CO2 (g) obedeçam a equação de estado de van der Waals expressa como: 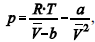 julgue o item que segue.
julgue o item que segue.
A temperatura T2 é inferior àquela verificada imediatamente
antes da compressão.

A partir das informações fornecidas, conclui-se que a molécula de H2O é um ligante de campo mais fraco do que a molécula de O2.

Com base nas informações e na figura apresentadas e considerando que a configuração eletrônica do íon Fe2+ é d6 , julgue o próximo item, de acordo com a teoria do campo cristalino.
A oxiemoglobina possui 4 elétrons desemparelhados e, por este
motivo, apresenta comportamento paramagnético.

Com base nas informações e na figura apresentadas e considerando que a configuração eletrônica do íon Fe2+ é d6 , julgue o próximo item, de acordo com a teoria do campo cristalino.
Na hemoglobina com uma molécula de H2O substituindo a
molécula de O2, a energia de estabilização do campo cristalino
é igual a - 0,4 × Δoct, em que Δoct é o valor do desdobramento
do campo cristalino.