Questões de Concurso Público SEDUC-AL 2021 para Professor - Química
Foram encontradas 63 questões
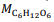 = 180 g/mol e
= 180 g/mol e 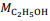 = 46 g/mol.
= 46 g/mol. Mesmo antes de os conceitos modernos serem desenvolvidos, as pessoas, por meio do aperfeiçoamento da capacidade de transformar os materiais, praticavam a química para ter mais domínio sobre o ambiente.
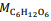 = 180 g/mol e
= 180 g/mol e 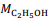 = 46 g/mol.
= 46 g/mol. De acordo com os experimentos de Faraday, a quantidade de produto formado ou de reagente consumido em uma reação eletrolítica é estequiometricamente proporcional à diferença de potencial aplicada entre os eletrodos da célula eletrolítica.
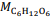 = 180 g/mol e
= 180 g/mol e 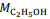 = 46 g/mol.
= 46 g/mol. A química distanciou-se da alquimia a partir dos ensaios de Robert Boyle, um dos primeiros pesquisadores a dar forma científica ao atomismo, opondo-se a Aristóteles e Paracelso.
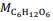 = 180 g/mol e
= 180 g/mol e 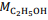 = 46 g/mol.
= 46 g/mol. De acordo com a lei de Lavoisier, na reação de fermentação da glicose para produzir somente etanol e gás carbônico, em recipiente fechado, a massa de glicose consumida é igual à massa de etanol produzida, que é igual à massa de CO2 liberada.
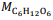 = 180 g/mol e
= 180 g/mol e 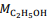 = 46 g/mol.
= 46 g/mol. De acordo com a reação descrita, para a obtenção de 1,0 kg de etanol, são necessários mais de 2,0 kg de glicose.
No íon NO3 − , há duas ligações mais longas e uma mais curta entre cada um dos átomos de oxigênio e o de nitrogênio.
Cátions e ânions estão mais fortemente ligados no NaCl que no KCl.
O ângulo de ligação entre átomos de hidrogênio é maior em uma molécula de amônia que em uma molécula de água.
O composto SnCl3 apresenta geometria molecular tetraédrica.
Nas ligações covalentes entre átomos diferentes, os pares de elétrons são compartilhados igualmente.
O comprimento da ligação entre o hidrogênio e o átomo de halogênio é maior no HI que no HF.
De acordo com a teoria de ligação de valência, o diagrama de orbitais para o átomo de Be, para formar orbitais híbridos no BeF2, está corretamente representado na figura a seguir.
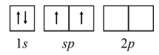
De acordo com a teoria de ligação de valência, a molécula de água é constituída por quatro orbitais híbridos do tipo sp3 arranjados de forma tetraédrica em torno do oxigênio, de maneira que dois orbitais participam das ligações simples O–H e outros dois acomodam os pares de elétrons não ligantes.
A molécula de N2H2 é linear e nela há uma dupla ligação entre os átomos de nitrogênio, sendo cada átomo de hidrogênio ligado a um dos átomos de nitrogênio.
Nos compostos formados por cátions e ânions muito polarizáveis, o caráter da ligação química é fortemente covalente.
Uma das principais vantagens da teoria de ligação de valência é a possibilidade de explicar, satisfatoriamente, fenômenos associados a estados de excitação e de prever os espectros de absorção e emissão de energia eletrônica das moléculas.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

As moléculas se organizam por meio de ligações covalentes entre si para formar os sólidos moleculares.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

Nos líquidos, a ordem de ligação tem mais curto alcance que nos sólidos cristalinos.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

No gráfico apresentado, os processos indicados pelas setas I e IV representam, respectivamente, os processos de vaporização e congelamento da referida substância.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

No gráfico apresentado, o segmento de curva entre os pontos O e T representa a curva de sublimação, que separa a fase sólida da fase gasosa, e cada ponto desse segmento é uma condição de equilíbrio entre o sólido e o gás.