Questões de Concurso Público SEED-PR 2021 para Professor - Química
Foram encontradas 32 questões
TE (H2O) = +100 °C TE (H2S) = −60 °C
Essas diferenças entre as temperaturas de ebulição das substâncias podem ser explicadas pela(o)
Assinale a opção que apresenta duas variedades alotrópicas de estrutura cristalina.
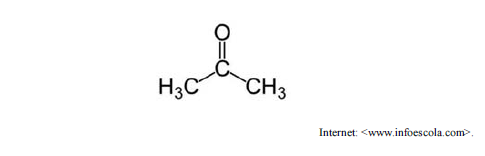
A propanona, cuja fórmula estrutural é mostrada anteriormente, é um composto orgânico que pertence à função das cetonas. Esse solvente é comercializado como acetona, um removedor comum de esmaltes utilizado em salões de beleza. A respeito da propanona, é correto afirmar que o carbono da carbonila possui geometria
Internet: <brasil.elpais.com> (com adaptações).
A esse respeito, assinale a opção correta.
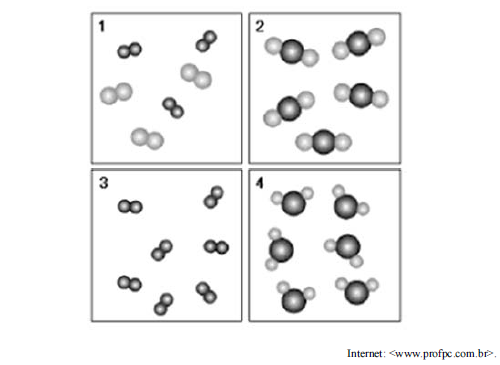
A figura precedente representa 4 sistemas formados por moléculas, em que bolinhas de cores diferentes representam átomos de elementos diferentes, e bolinhas juntas, que os átomos estão ligados entre si. Assinale a opção correta, de acordo com essa figura.
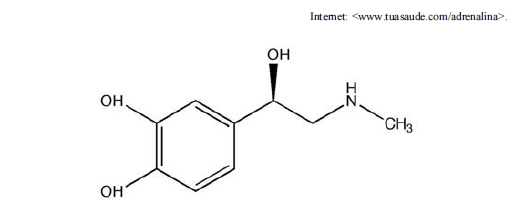
Considerando-se a fórmula estrutural da adrenalina, representada na figura precedente, é correto afirmar que o número de ligações sigma e pi presentes em uma molécula de adrenalina corresponde, respectivamente, a
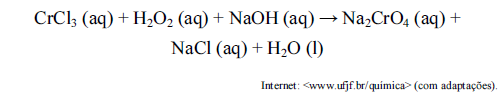
A respeito da reação de oxirredução não balanceada citada no texto acima, assinale a opção correta.
A partir dessa informação, considere que uma pessoa com massa corporal de 70 kg tenha doado sangue em um hemocentro. Sabendo-se que M (C6H12O6) = 180 g/mol, que o volume retirado de sangue correspondeu a 9 mL/kg e que o nível de glicose nesse sangue é de 0,80 mg/mL, é correto afirmar que foram doados por este paciente
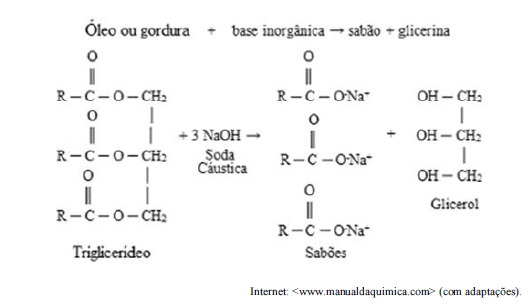
Com relação à reação de saponificação mostrada no texto anterior, assinale a opção correta.
A exposição à radiação ultravioleta pode causar queimadura na pele, lesão em células epiteliais, alteração do DNA, inflamação, dilatação dos vasos sanguíneos, câncer, entre outros fatores adversos. O ozônio (O3) existente na estratosfera atua como um filtro dos raios ultravioletas provenientes do Sol.
A exposição à radiação ultravioleta pode causar queimadura na pele, lesão em células epiteliais, alteração do DNA, inflamação, dilatação dos vasos sanguíneos, câncer, entre outros fatores adversos. O ozônio (O3) existente na estratosfera atua como um filtro dos raios ultravioletas provenientes do Sol.
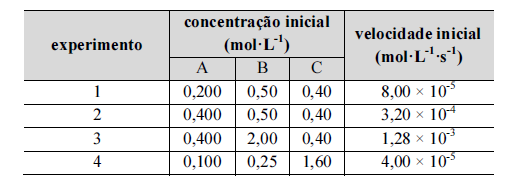
Com relação à situação hipotética precedente, assumindo-se v como a velocidade da reação e k como a constante de velocidade, é correto afirmar que a lei de velocidade dessa reação é dada por
Com base nessas informações, é correto afirmar que, se as concentrações iniciais de quinina e de ácido forem, respectivamente, de 0,250 mol/L e 0,160 mol/L, então a velocidade inicial da reação será igual a
NO (g) + O3 (g) ⇌ NO2 (g) + O2 (g)
Estudos mostraram que, quando esses dois gases são colocados em um mesmo recipiente a 25 °C e 1 atm, cada molécula colide, em média, cerca de um bilhão de vezes por segundo com outras moléculas. Se todas essas colisões resultassem em formação de produto, a reação aconteceria em uma fração de segundo. Porém, não é isso que se observa empiricamente, sendo a reação muitíssimo mais lenta.
Nesse caso, para que a reação aconteça, a simples colisão entre as moléculas não é suficiente; é necessário, também, que
O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.

O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.

I O aumento da pressão aumentou a velocidade da reação até atingir o limite desse parâmetro, pois, com o aumento da pressão de H2, mais hidrogênio foi dissolvido na solução.
II O aumento da pressão aumentou a velocidade da reação, o que comprova que a reação é de 1.ª ordem em relação ao hidrogênio.
III O fato de haver um limite para o aumento da velocidade da reação devido à pressão indica que existe uma capacidade limitada do catalisador de suportar o H2.
Assinale a opção correta.
O álcool estearílico é usado na indústria de cosméticos para a produção de cremes, loções, máscaras capilares, entre outros, por ser compatível com vários tipos de emulsionantes e apresentar baixa irritabilidade na pele.
