Questões de Concurso Público SESAU-AL 2021 para Bioquímico
Foram encontradas 120 questões
Tendo as informações apresentadas como referência, julgue o item que se segue.
A reação de formação do clorometano é classificada como
uma reação de substituição via radical que ocorre em três
etapas.
Tendo as informações apresentadas como referência, julgue o item que se segue.
O metano (CH4) é um combustível menos poluente que a
gasolina (C8H18) quando se leva em consideração a
combustão completa de 1 kg destes combustíveis.
Tendo as informações apresentadas como referência, julgue o item que se segue.
O clorofórmio, solvente orgânico que já foi usado como
anestésico, possui alto grau de toxicidade e pode ser obtido
pela reação de substituição do metano.
O bicarbonato de sódio é comumente utilizado como antiácido estomacal para aliviar a sensação de mal estar após a ingestão de grande quantidade de alimentos, por exemplo. Sabendo que um adulto tem, em média, 100 mL de suco gástrico e que a concentração de ácido clorídrico é de 0,01 mol/L, julgue o item seguinte.
A reação entre o bicarbonato de sódio e o ácido clorídrico
pode ser classificada como neutralização.
O bicarbonato de sódio é comumente utilizado como antiácido estomacal para aliviar a sensação de mal estar após a ingestão de grande quantidade de alimentos, por exemplo. Sabendo que um adulto tem, em média, 100 mL de suco gástrico e que a concentração de ácido clorídrico é de 0,01 mol/L, julgue o item seguinte.
A massa de bicarbonato de sódio necessária para neutralizar
os 100 mL de suco gástrico é de 0,84 g, considerando-se que
o antiácido estomacal tem 80% de pureza de bicarbonato de
sódio na sua composição.
O bicarbonato de sódio é comumente utilizado como antiácido estomacal para aliviar a sensação de mal estar após a ingestão de grande quantidade de alimentos, por exemplo. Sabendo que um adulto tem, em média, 100 mL de suco gástrico e que a concentração de ácido clorídrico é de 0,01 mol/L, julgue o item seguinte.
Caso a quantidade de suco gástrico fosse reduzida pela
metade, a massa de bicarbonato utilizada para neutralizar
também deveria ser reduzida pela metade.
O bicarbonato de sódio é comumente utilizado como antiácido estomacal para aliviar a sensação de mal estar após a ingestão de grande quantidade de alimentos, por exemplo. Sabendo que um adulto tem, em média, 100 mL de suco gástrico e que a concentração de ácido clorídrico é de 0,01 mol/L, julgue o item seguinte.
O ponto estequiométrico dessa titulação de neutralização
ocorre com um pH < 7.
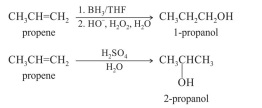
Considerando as informações apresentadas, julgue o item subsequente.
O produto obtido na reação de hidroboração do propano
seguiu a regra de Markovnikov.

Considerando as informações apresentadas, julgue o item subsequente.
Na oximercuriação seguida de redução para os alcenos, o
produto obtido segue a regra de Markovnikov, desta forma
podemos concluir que na reação do 2-metilpent-2-eno, o
produto formado é o 2-metilpentan-3-ol.

Considerando as informações apresentadas, julgue o item subsequente.
A reação de hidroboração do propano pode ser classificada
como uma reação de adição eletrofílica.

Considerando as informações apresentadas, julgue o item subsequente.
O produto obtido na reação de hidroboração, na presença de
hidróxido de sódio e água oxigenada, do 4-fenil-2-metilbut1-eno é o 4-fenil-2metilbutan-1-ol.
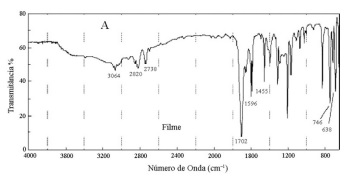
A partir das informações apresentadas anteriormente, julgue o item a seguir.
O espectro de infravermelho acima se refere à substância
benzaldeído.

A partir das informações apresentadas anteriormente, julgue o item a seguir.
O cálculo do IDH para essa substância é igual a 5, portanto
pode-se inferir que ela tem um anel aromático em sua
estrutura.

A partir das informações apresentadas anteriormente, julgue o item a seguir.
A presença de absorção a 1702 cm-1 (nC=O) juntamente
com o dubleto de Fermi (2820 e 2738 cm-1) é indicativo de
função cetona.
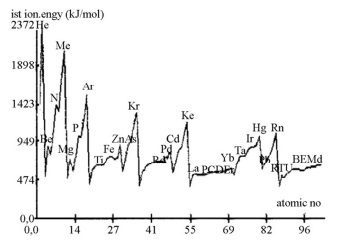
Considerando essas informações bem como a tabela periódica e a química dos elementos, julgue o item seguinte.
É possível inferir do gráfico que os gases nobres são os
átomos que apresentam os maiores valores para a primeira
energia de ionização.

Considerando essas informações bem como a tabela periódica e a química dos elementos, julgue o item seguinte.
Pode-se inferir do gráfico que a energia de ionização do
átomo de césio é aproximadamente 474 kJ/mol.

Considerando essas informações bem como a tabela periódica e a química dos elementos, julgue o item seguinte.
Ao longo do mesmo período da tabela periódica, é mais
fácil retirar os elétrons da camada de valência do átomo,
quanto maior for o seu número atômico.
A partir dessas informações, julgue o item subsecutivo.
O produto de uma reação de redução de um éster é um álcool
primário.
A partir dessas informações, julgue o item subsecutivo.
A reação de redução do butanal, na presença de boro-hidreto
de sódio, produz o butan-1-ol.
A partir dessas informações, julgue o item subsecutivo.
A redução de ácidos carboxílicos acontece com a adição de
um íon hidreto eletrófilo ao carbono nucleofílico do grupo
carbonila.