Questões de Concurso Público FUB 2022 para Químico
Foram encontradas 70 questões

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
Ácidos fracos podem ser determinados por titulometria de
neutralização, mas não os ânions deles derivados.

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
Se a curva de titulação tivesse apenas um ponto de inflexão
negativa, então seria correto concluir que a amostra conteria
apenas NaOH.
No que se refere aos fundamentos dos métodos espectroscópicos de análise, julgue o próximo item.
Existem duas limitações instrumentais importantes para a
Lei de Beer-Lambert: essa lei é estritamente válida para
radiações monocromáticas puras, o que é muito difícil de
conseguir; e radiações de fundo, originadas por imperfeições
no seletor de comprimento de onda, podem atingir o
detector. Essas limitações são as principais causas dos
desvios da Lei de Beer-Lambert.
No que se refere aos fundamentos dos métodos espectroscópicos de análise, julgue o próximo item.
Vários tipos de transições entre níveis de energia
quantizados dão origem aos espectros moleculares de
UV-VIS, entre as quais se destacam as transições n → π* e
π → π*, porque envolvem grupos funcionais característicos
das substâncias e comprimentos de onda que são facilmente
acessíveis.
No que se refere aos fundamentos dos métodos espectroscópicos de análise, julgue o próximo item.
As bandas de absorção são normalmente muito mais amplas
nos espectro de UV-VIS que nos de infravermelho (IV).
No que se refere aos fundamentos dos métodos espectroscópicos de análise, julgue o próximo item.
Diferentemente do que ocorre na espectroscopia de absorção
molecular, na espectroscopia de absorção atômica a lâmpada
precisa ser substituída caso se analisem analitos distintos.
No que se refere aos fundamentos dos métodos espectroscópicos de análise, julgue o próximo item.
A maioria dos compostos aromáticos não heterocíclicos não
substituídos apresentam rendimentos quânticos de
fluorescência elevados o suficiente para uma análise bem
sucedida por espectroscopia de fluorescência. Moléculas
com sistemas de vários anéis aromáticos e com estruturas
planares rígidas costumam apresentar alta fluorescência.
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
O físico-químico Gilbert Newton Lewis explicou o modelo
das ligações químicas.
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
O modelo da repulsão dos pares de elétrons da camada de
valência aplicado à molécula SF4 leva à conclusão de que
sua estrutura molecular é piramidal quadrática.
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
O físico-químico Gilbert Newton Lewis propôs a regra do
octeto.
Acerca de ligações químicas e estruturas moleculares, julgue o item seguinte.
A estrutura de Lewis para o íon tetrafluoroborato (BF4 − ) é a mostrada a seguir.
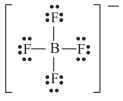
A respeito de ácidos e bases, julgue o item a seguir.
Um ácido de Brønsted é um receptor de próton.
A respeito de ácidos e bases, julgue o item a seguir.
O BF3 é uma base de Lewis porque o elemento boro (B)
pode receber um par de elétrons.
A respeito de ácidos e bases, julgue o item a seguir.
Por ser um ácido forte, o ácido fluorídrico é muito corrosivo.
A respeito de ácidos e bases, julgue o item a seguir.
Quanto mais forte for a base, mais fraco será o seu ácido
conjugado.
A respeito de ácidos e bases, julgue o item a seguir.
Quando uma espécie ganha um próton, torna-se a base
conjugada.
Julgue o item seguinte, relativos às propriedades periódicas.
Via de regra, quanto maiores forem os raios atômicos, mais
elevadas serão as energias de ionização.
Julgue o item seguinte, relativos às propriedades periódicas.
Na tabela periódica, os raios atômicos aumentam de cima
para baixo no sentido vertical das famílias e diminuem da
esquerda para a direita no sentido horizontal dos períodos.
Julgue o item seguinte, relativos às propriedades periódicas.
A energia de ionização é aquela liberada quando um átomo
isolado no estado fundamental, em fase gasosa, recebe um
elétron.
Sabendo que ZPt = 78, julgue o item que se segue, acerca do complexo [Pt(NH3)2Cl2], cujas estruturas possíveis são mostradas nas figuras 1 e 2.
A figura 2 corresponde ao complexo
cis-diaminodicloroplatina (II).
