Questões de Concurso Público UFRN 2018 para Farmacêutico
Foram encontradas 30 questões
Para que um método de análise seja utilizado na rotina de um laboratório de controle de qualidade, é necessário que ele seja validado. No Brasil, os requisitos para a validação de um método analítico são descritos na RDC 166/2017 da Anvisa. Considere as seguintes afirmativas sobre os parâmetros de validação.
I Limite de detecção é a menor quantidade do analito presente em uma amostra que pode ser detectado, porém, não necessariamente quantificado, sob as condições experimentais estabelecidas.
II Precisão é o grau de concordância entre os resultados individuais do método em estudo em relação a um valor aceito como verdadeiro.
III Robustez é a capacidade de identificar ou quantificar o analito de interesse, inequivocamente, na presença de componentes que podem estar na amostra, como , impurezas, diluentes e componentes da matriz.
IV Linearidade é a capacidade de uma metodologia analítica de demonstrar que os resultados obtidos são diretamente proporcionais à concentração do analito na amostra, dentro de um intervalo especificado.
Estão corretas as afirmativas
Os testes de contagem do número total de micro-organismos mesofílicos e a pesquisa de micro-organismos patogênicos são preconizados pela Farmacopeia Brasileira para produtos farmacêuticos não estéreis. Com relação ao teste de contagem, há um limite máximo preconizado para cada categoria de produto farmacêutico existente. Na tabela abaixo, é apresentado o resultado de um teste de contagem microbiana em um produto líquido não estéril.
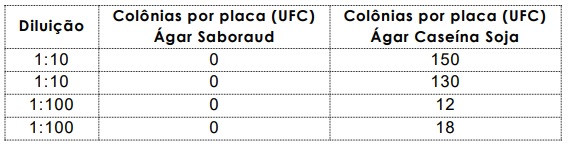
De acordo com os dados da tabela, o número de unidades formadoras de colônia (UFC) de
bactérias por mililitro desse produto é
O procedimento a seguir é descrito na Farmacopeia Brasileira, 5ª edição (Anvisa, 2010) para a avaliação de substâncias relacionadas na monografia de Varfarina matéria prima .
Substâncias relacionadas. Proceder conforme descrito em Cromatografia em camada delgada (5.2.17.1), utilizando sílica-gel GF254, como suporte, e mistura de ácido acético glacial, cloreto de metileno e cicloexano (20:50:50) como fase móvel. Aplicar, separadamente, à placa, 20 μL de cada uma das soluções, recentemente preparadas, descritas a seguir.
Solução (1): dissolver 0,20 g da amostra em acetona e diluir para 10 mL com o mesmo solvente.
Solução (2): diluir 2 mL da Solução (1) em 10 mL de acetona.
Solução (3): diluir 1 mL da Solução (2) em 200 mL de acetona.
Solução (4): dissolver 40 mg de varfarina SQR em acetona e diluir para 10 mL com o mesmo solvente.
Solução (5): transferir 10 mg de acenocumarol SQR e 1 mL da Solução (1) para balão volumétrico de 10 mL, diluir com acetona e completar o volume com o mesmo solvente.
Desenvolver o cromatograma. Remover a placa, deixar secar ao ar. Examinar os
cromatrogramas obtidos sob luz ultravioleta (254 nm). Qualquer mancha obtida no
cromatograma com a Solução (1), com exceção da mancha principal, não pode ser mais
intensa que a obtida no cromatograma com a Solução (3) (___%). O teste não é válido a
não ser que o cromatograma obtido com a Solução (5) mostre duas manchas claramente
separadas e que a mancha do cromatograma obtida com a Solução (3) seja claramente
visível.
O limite individual de substâncias relacionadas para a Varfarina, em porcentagem, é
Considere a informação presente no texto abaixo.
Segundo a Farmacopeia Brasileira, 5ª edição (Anvisa, 2010), a máxima diluição válida (MDV) é "a máxima diluição permitida da amostra em análise onde o limite de endotoxina pode ser determinado. Ela se aplica para injeções ou soluções de administração parenteral na forma reconstituída ou diluída para administração, quantidade de fármaco por peso, se o volume da forma da dosagem for variável".
Para o produto Ciprofloxacino solução injetável 2 mg/mL, o limite de endotoxinas é 1,76 UE/mL. Utilizando-se um reagente LAL de sensibilidade rotulada (λ), de 0,25 UE/mL, o valor da MDV para esse teste é
Um teste de uniformidade de doses unitárias foi realizado segundo o método geral 5.1.6 da Farmacopeia Brasileira, 5ª edição (Anvisa, 2010), e foram obtidos os seguintes valores:
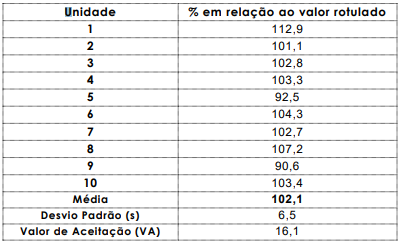
Com base nesses dados, conclui-se que
Considere o procedimento abaixo, descrito na Farmacopeia Brasileira, 5ª edição (Anvisa, 2010), para o doseamento de cloridrato de pilocarpina (C11H16N2O2.HCl) matéria prima.
Pesar, exatamente, cerca de 2 g de amostra e dissolver em 60 mL de água. Titular com hidróxido de sódio M SV e determinar o ponto final potenciometricamente. Cada mL de hidróxido de sódio M SV equivale a 244,720 mg de C11H16N2O2.HCl.
O volume de hidróxido de sódio M SV a ser gasto na titulação de 2,1 g de cloridrato de
pilocarpina é
O cloranfenicol (C11H12Cl2N2O5) é um antibiótico de amplo espectro que atua na inibição da síntese proteica dos micro-organismos sensíveis. Sua estrutura química é apresentada na figura abaixo:
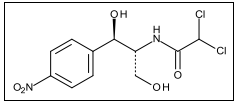
Com relação à estabilidade do cloranfenicol, em solução aquosa de pH 3,0, o mecanismo de
degradação a que ele está sujeito é