Questões de Concurso Público UFAM 2016 para Técnico de Laboratório - Química
Foram encontradas 25 questões
Qualquer laboratório, principalmente de Química, pode se tornar em um local muito perigoso, quando se usa inadequadamente materiais e equipamentos. Nesse contexto, é importante o conhecimento de boas práticas de laboratório. Com relação a essas práticas, identifique se são verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) No encerramento do expediente, não se deve deixar equipamentos elétricos ligados nas tomadas, sob hipótese alguma.
( ) Para exercer as atividades de laboratório é obrigatório o uso de guarda-pó, sapatos fechados e cabelos presos.
( ) Na bancada ou nos bancos, quando for o caso, pode-se colocar livros, sacolas, ferramentas etc.
( ) É proibido fumar no laboratório. Somente será permitido fumar na capela, onde a saúde dos usuários não será exposta a risco.
( ) Deve-se sempre manter os acessos desimpedidos,e o interior do laboratório limpo e organizado.
Assinale a alternativa que apresenta a sequência CORRETA, de cima para baixo:
Responder numerando corretamente a questão da coluna da direita, que descreve a finalidade do uso de EPIs e outros cuidados pessoais que devem ser observados para proteção individual, de acordo com a coluna da esquerda, que apresenta a classificação dos mesmos:
1. Cabelos preferencialmente mantidos presos ou sob gorros
2. Guarda-pó
3. Luvas de procedimentos
4. Óculos
5. Restrições ao uso de joias ou similares
6. Sapatos fechados
( ) Evitar danos nos materiais nobres mediante processo oxidação
( ) Evitar o contato com material biológico ou químico durante a manipulação de materiais e uso de equipamentos
( ) Proteção dos olhos contra respingos e resíduos de vidros ou outros materiais
( ) Proteção dos pés quanto a impactos e derramamentos de líquidos corrosivos
( ) Proteção quanto à manipulação de reagentes diversos
( ) Proteção quanto à manipulação de reagentes, equipamentos e procedimentos laboratoriais
A alternativa que contém a sequência correta dos
números da coluna da direita, de cima para baixo, é:
Relacione o tipo de resíduo químico (coluna à esquerda) com o respectivo exemplo (coluna à esquerda):
Tipo de Resíduos Químicos
I. Básicos
II. Metais preciosos ou recicláveis
III. Oxidantes fortes
IV. Redutores fortes (exceto metais e ligas)
V. Solventes descartáveis
VI. Solventes recicláveis
Exemplo
( ) Soluções ou sais de dicromato, permanganato, hipoclorito, iodato, persulfato, bismuto (III). Solução de bromo, iodo, peróxido de hidrogênio. Sólidos: bismutato de sódio, dióxido de chumbo e ácido crômico.
( ) Cabeça e cauda de destilação, solvente de limpeza, solventes contaminados de difícil purificação e misturas azeotrópicas.
( ) Hidrazina, soluções ou sais de sulfito, iodeto, tiossulfato, oxalato, ferro (II), estanho (II) e fósforo vermelho.
( ) Aminas, soluções de hidróxidos, soda cáustica, solução alcoolato e amônia.
( ) Solventes de HPLC, extração Sohxlet e rotaevaporados, e formol.
( ) Sais ou soluções contendo prata, ósmio, ouro, platina e rutênio.
Assinale a alternativa com a sequência CORRETA
de cima para baixo:
Para que os resíduos de laboratório possam ser eliminados de forma adequada, é necessário ter à disposição recipientes de tipo e tamanho adequados. Os recipientes coletores devem ser caracterizados claramente de acordo com o seu conteúdo, o que também implica em se colocar símbolos de periculosidade. No caso de embalagem para resíduos químicos perigosos, pode-se afirmar que:
I. Resíduos líquidos contendo solventes devem ser armazenados em garrafas de vidro ou bombonas de material compatível.
II. Resíduos líquidos isentos de solventes devem ser armazenados em frascos metálicos ou de aço inoxidável.
III. Resíduos sólidos e lodos devem ser armazenados em recipientes (embalagens) individuais resistentes à ruptura.
Assinale a alternativa correta:
A ocorrência de acidentes em laboratório, infelizmente, não é tão rara como possa parecer. Com a finalidade de diminuir a frequência e a gravidade desses eventos, torna-se absolutamente imprescindível que, durante os trabalhos realizados em laboratório, se observe uma série de normas de segurança. Para exemplificar o assunto são apresentadas algumas normas:
I. Evite contato de qualquer substância com a pele (evite passar os dedos na boca, nariz, olhos e ouvidos). Se alguma substância cair na sua pele, lave imediatamente com bastante água.
II. Não deixe vidro quente em local em que possa pegá-lo inadvertidamente.
III. Se algum ácido ou qualquer outro produto químico for derramado, lave o local imediatamente com uma solução básica.
IV.Os tubos de ensaio contendo líquidos devem ser aquecidos pela parte do meio e não pelo fundo e utilize pinça de madeira para esta finalidade. Quando aquecer uma substância num tubo de ensaio, não volte a extremidade aberta do mesmo para si ou para uma pessoa próxima.
V. Seja particularmente cuidadoso quando preparar soluções ácidas e básicas. No caso de solução ácida, adicione água destilada no ácido concentrado.
Assinale a alternativa correta:
Observe o frasco da figura a seguir que contém uma solução aquosa de ácido sulfúrico (H2SO4) utilizada em laboratório, e responda, sabendo que o volume da solução contida no frasco é 2,0 L:
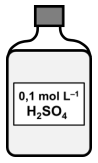
Qual o volume dessa solução necessário para obter
uma solução de 250 mL de H2SO4 com 0,025 mol L–1
?
Para atender aos procedimentos de rotinas laboratoriais, usamos vários tipos de soluções e concentrações. Para exemplificar, um técnico adicionou 100 mL de água destilada em 10 g de composto S, em pó e seco (CaCO3). A partir dos dados, obtiveram-se os resultados: (densidade da água, ρ = 1 g mL–1; massa molar do CaCO3 = 100 g mol–1):
I. Concentração comum: C = 0,1 g mL–1 .
II. Concentração molar: [X] = 0,5 mol L–1 .
III. Concentração molal: b = 1 mol kg–1 .
IV.Concentração percentual: %C = 10% m/V.
V. Fração molar de S: XS ≈ 0,1.
Assinale a alternativa correta:
Os indicadores são substâncias naturais ou sintéticas que apresentam cores bem distintas em ácido e básico. Para uma série de indicadores, as seguintes cores e faixa de pH sobre a qual a mudança de cor ocorre são apresentadas na tabela abaixo:

Assinale a alternativa que apresenta a afirmação
CORRETA:
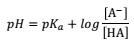
em que, o HA é o ácido e A– é a base conjugada.
Com base no exposto, identifique as afirmativas verdadeiras.
I. O pH da solução será igual ao pKa se a [A– ] for igual a [HA]
II. O pH tende a aumentar se a concentração a [A– ] for maior que [HA]
III. O pH tende a diminuir se a concentração a [A– ] for maior que [HA]
IV.O pH tende a aumentar se a concentração a [A– ] for menor que [HA]
V. O pH tende a diminuir se a concentração a [A– ] for menor que [HA]
Assinale a alternativa correta:
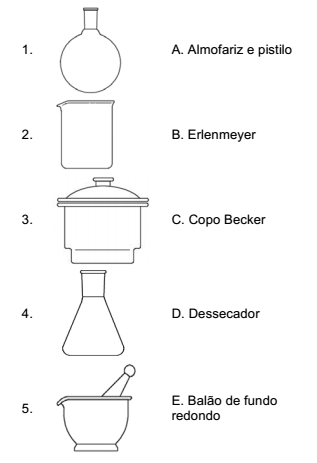
Assinale a alternativa que correlaciona, corretamente, as colunas.
Devido à grande emissão de gases lançados na atmosfera, nas regiões mais populosas é evidente a ocorrência da chuva ácida. Na sua precipitação, um dos ácidos responsáveis pela acidez é o sulfúrico. Um equilíbrio envolvido na formação desse ácido na água da chuva está representado pela equação:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Considere que são colocados 6 mol de SO2, 5 mol de O2 e 4 mol de SO3 num recipiente fechado de 5,0 L para reagirem até o sistema atingir o equilíbrio a dada temperatura. A variação do número de mol dos gases participantes está registrada no gráfico.
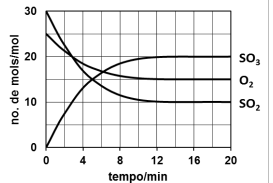
Nestas condições, a constante de equilíbrio, KC, é
igual a:

Assinale a alternativa correta: