Questões de Concurso Público SEDUC-PA 2018 para Professor Classe I - Química
Foram encontradas 50 questões
“Uma série de experiências sob a direção de Ernest Rutherford, em 1911, forneceu uma ideia mais clara sobre a natureza do átomo. Essas experiências foram conduzidas por Johannes Geiger, físico alemão que trabalhava com Rutherford e Ernest Marsden, um estudante em Cambridge. Eles bombardearam uma lâmina fina de ouro com partículas alfa. Com uma tela fluorescente, observaram o grau de espelhamento das partículas alfa. A maioria delas atravessava a lâmina com alteração na direção. Algumas, entretanto, eram fortemente refletidas. Os números relativos de partículas alfa refletidas a diferentes ângulos eram contados. Por análise matemática das forças envolvidas, Rutherford demonstrou que o espalhamento era causado por uma carga central de grande volume, carregada positivamente e situada no interior do átomo de ouro.”
(Adaptado de Masterton, 2009.)
Podemos observar no trecho que há incoerência relacionada à experiência de Rutherford e seus colaboradores.
Assinale a alternativa que refere-se ao ERRO encontrado no trecho.
“Uma série de experiências sob a direção de Ernest Rutherford, em 1911, forneceu uma ideia mais clara sobre a natureza do átomo. Essas experiências foram conduzidas por Johannes Geiger, físico alemão que trabalhava com Rutherford e Ernest Marsden, um estudante em Cambridge. Eles bombardearam uma lâmina fina de ouro com partículas alfa. Com uma tela fluorescente, observaram o grau de espelhamento das partículas alfa. A maioria delas atravessava a lâmina com alteração na direção. Algumas, entretanto, eram fortemente refletidas. Os números relativos de partículas alfa refletidas a diferentes ângulos eram contados. Por análise matemática das forças envolvidas, Rutherford demonstrou que o espalhamento era causado por uma carga central de grande volume, carregada positivamente e situada no interior do átomo de ouro.”
(Adaptado de Masterton, 2009.)
Sobre o núcleo central descoberto por Rutherford, analise as afirmativas a seguir.
I. Possui uma carga positiva de valor igual ao total da carga negativa dos elétrons nas camadas externas do núcleo.
II. É responsável por mais de 99,9% da massa do total do átomo.
III. Possui um diâmetro equivalente a apenas 0,01% do diâmetro do próprio átomo. Se o átomo pudesse ser estendido para cobrir esta página, o núcleo seria praticamente invisível sob a forma de um pequeno ponto cerca de 10 vezes menor do que o ponto que termina essa frase.
Estão corretas as afirmativas
Em seus compostos, o enxofre apresenta números de oxidação +6, +4, +2 e –2. São várias as espécies em solução ácida e básica. Nas espécies protonadas, os átomos de H estão ligados aos átomos de oxigênio dos oxiânicos. As espécies sulfuradas possuem diferentes potenciais padrão. Há de se notar que os oxiânicos de enxofre são agentes oxidantes muito mais fracos do que os de nitrogênio. Ainda sobre espécies de enxofre, analise as afirmativas a seguir.
I. Espécies no estado +6, no estado +4 e no estado +2 podem atuar apenas como agentes oxidantes, e nunca como agentes redutores, em reações redox.
II. Espécies no estado 0 (zero) podem atuar como agentes oxidantes ou como agentes redutores.
III. Espécies no estado –2 podem atuar apenas como agentes redutores, e nunca como agentes oxidantes, em reações redox.
Estão corretas as afirmativas
Para determinar a equação de velocidade correspondente a um dado mecanismo, são feitos os seguintes passos:
01. Localizar a etapa lenta no mecanismo. A velocidade da reação global será a velocidade desta etapa.
02. Escrever a equação de velocidade para a etapa lenta. Para isso, é notado que o expoente de um reagente na equação de velocidade para uma etapa é seu coeficiente na equação para essa etapa.
03. Se a equação de velocidade obtida em 02 contiver um intermediário instável, o termo dessa espécie deve ser eliminado. Frequentemente, isto pode ser feito trabalhando-se com a constante de equilíbrio para uma etapa rápida no mecanismo.
De acordo com as informações anteriores, assinale a alternativa que corresponde aos passos para a determinação da equação de velocidade.
Várias são as propriedades de metais de transição comparadas às dos metais do grupo principal, como podemos observar no quadro a seguir.
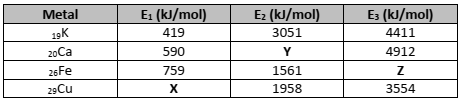
As letras X, Y e Z correspondem a valores de energia de ionização para os determinados elementos. Assinale a
afirmativa correta em relação aos valores de X, Y ou Z.
Afirma-se que ΔG é o critério básico de espontaneidade. Uma reação ocorre espontaneamente se ΔG tem valor negativo. Lembrando que por tratamento termodinâmico, a fórmula da variação da energia livre padrão é definida por: ΔGo = – RT ln K. Se substituirmos R por 8,31 x 10–3 (quilojoules por Kelvin) e ln K por 2,30 log10 K, tem-se a seguinte fórmula descrita:
ΔGo (em quilojoules) = –2,30(8,31 x 10–3 )T log10K = –0,0191T log10K
Assinale a alternativa que NÃO contempla a energia livre padrão em sua fórmula substituída:
Vários compostos orgânicos com átomos de halogênios diferentes de cloro foram ou são usados comercialmente. Como exemplo, os fréons são utilizados como propelentes de aerossóis e como gases de refrigerante, o 1,2-dibrometano (EBD) é utilizado como inseticida em grãos, o ácido 2,4-diclorofenoxiacético é utilizado como herbicida. Sabendo qual a função orgânica e como ela se caracteriza no composto, podemos compreender qual uso o composto poderá ter.
Analise, a seguir, a tabela de compostos e alguns usos específicos.

Vários compostos orgânicos com átomos de halogênios diferentes de cloro foram ou são usados comercialmente. Como exemplo, os fréons são utilizados como propelentes de aerossóis e como gases de refrigerante, o 1,2-dibrometano (EBD) é utilizado como inseticida em grãos, o ácido 2,4-diclorofenoxiacético é utilizado como herbicida. Sabendo qual a função orgânica e como ela se caracteriza no composto, podemos compreender qual uso o composto poderá ter.
Analise, a seguir, a tabela de compostos e alguns usos específicos.

Observe o gráfico que demonstra a região de duas fases e a continuidade dos estados.
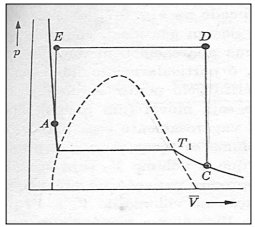
De acordo com a figura anterior, analise as afirmativas a seguir.
I. Os pontos A e C pertencem à mesma isoterma.
II. O ponto C representa um estado gasoso e o ponto A um sólido obtido comprimindo-se o gás isotermicamente.
III. A reta EA mostra quando o volume é mantido constante e o gás é resfriado, diminuindo a pressão.
IV. Em nenhum instante dessa série de mudanças o ponto que representa o estado do gás passou através da região de duas fases.
Estão corretas as afirmativas
Analise a figura acerca do ponto triplo.
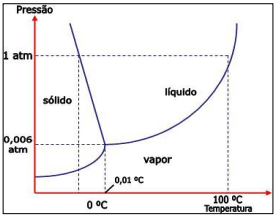
De acordo com a imagem anterior, assinale a alternativa correta.
Muitas reações envolvem o ganho ou a perda de energia e são chamadas de reações endotérmicas ou exotérmicas. Para o estudo quantitativo desta variação de energia utilizamos ΔH, que é igual à quantidade de calor trocado à pressão constante. Nesse estudo, foram formuladas três leis conhecidas como Leis da Termodinâmica; analise-as.
I. O valor de ΔH é diretamente proporcional à quantidade de reagente ou produto, desde que não haja reagente limitante.
II. O ΔH para uma reação é igual em módulo, mas de sinal contrário ao ΔH da reação inversa, ou seja, a quantidade de calor liberado e a de calor recebido são iguais.
III. O valor de ΔH para uma reação é o mesmo, seja a reação direta ou em etapas.
Corresponde(m) às Leis da Termodinâmica apenas
“Na prática não é sempre possível, nem de interesse, ter-se as concentrações iônicas, das espécies presentes, iguais a 1M ou atividade unitária. Assim sendo, tem-se os valores de potenciais diferentes dos apresentados na tabela de potenciais padrão. Para determinação desses novos potenciais, emprega-se a equação de Nernst.”
(Gentil, 2012.)
“Na prática não é sempre possível, nem de interesse, ter-se as concentrações iônicas, das espécies presentes, iguais a 1M ou atividade unitária. Assim sendo, tem-se os valores de potenciais diferentes dos apresentados na tabela de potenciais padrão. Para determinação desses novos potenciais, emprega-se a equação de Nernst.”
(Gentil, 2012.)