Questões de Concurso Público IF Goiano 2017 para Técnico de Laboratório - Química
Foram encontradas 24 questões
O iodeto de hidrogênio pode ser preparado a partir do hidrogênio e do iodo moleculares na fase gasosa, conforme equação a seguir
H2(g) + I2(g) ⇋ 2HI(g)
Em um dado momento, pode-se determinar o seu quociente de reação (Qc), que representa a razão das concentrações iniciais dos produtos e dos reagentes. Nessa reação, se o valor encontrado de Qc for menor que o valor da
sua constante de equilíbrio (Kc), então,
A amônia pode ser preparada industrialmente pelo processo de Haber-Bosch, representado pela equação não balanceada a seguir.
N2(g) + H2(g) ⇌ NH3(g)
Supondo-se que a 300 ºC, esse experimento apresente concentração de N2 e de H2 de 0,3 e 2,0 mol L-1, respectivamente, e que a constante de equilíbrio Kc seja 10, a concentração de NH3, em mol L-1, nessa temperatura, deve ser, aproximadamente, de
Considere a reação hipotética X + Y ⇌ W, cuja velocidade de reação (v) foi determinada a partir das concentrações iniciais de X e Y, segundo os experimentos apresentados na tabela a seguir.
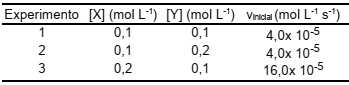
Baseando-se nos resultados apresentados na tabela, a
constante de velocidade de reação (k), em mol L-1 s-1
, é,
aproximadamente, igual a
Considere os valores de entalpia padrão de formação de alguns compostos químicos apresentados na tabela a seguir.

Com base nas informações apresentadas, a variação de
entalpia, em kJ, para a reação de combustão completa de
um mol do gás propano (C3H8) é, aproximadamente:
Determinado composto orgânico foi submetido à análise química e a porcentagem de cada elemento químico que o constitui foi determinada. Os resultados estão apresentados na tabela a seguir.

Com base nas informações apresentadas, a fórmula mínima do composto é:
O p-nitrotolueno, um composto orgânico aromático, sofreu uma mono nitração após ser tratado com uma mistura de ácido nítrico e ácido sulfúrico, conforme descrito na figura que segue.
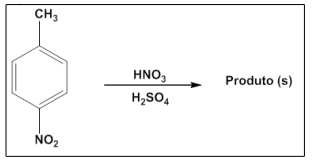
O número de produto(s) obtido(s) será igual a
Com base no conhecimento da estrutura química das moléculas orgânicas, essas podem ser manipuladas a partir de condições reacionais específicas e transformadas em outros compostos, conforme sugere a figura a seguir.
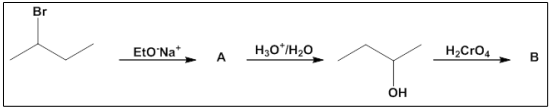
Considerando os produtos principais das reações, os compostos orgânicos A e B são, respectivamente:
Uma massa de 0,10 g de ácido benzoico (112 g mol-1) foi dissolvida em solvente apropriado e transferida quantitativamente para um erlenmeyer e adicionaram-se gotas de fenolftaleína. Posteriormente, adicionou-se uma solução de NaOH (40 g mol-1) de concentração desconhecida que consumiu um volume de 8,0 mL. A reação química que ocorre entre o ácido e a base está apresentada na figura que segue.
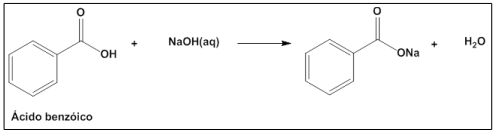
A concentração, em mol L-1, da solução de hidróxido de sódio é, aproximadamente:
75 mL de uma solução de HCl 0,100 mol L-1 foram misturados com 25 mL de uma solução de NaOH 0,100 mol L-1 . Considerando essas informações, o pH da solução final foi igual a:
Dado: log 5 = 0,70
Uma pilha foi montada com eletrodos de Al e Fe. Considerando as semirreações e os potenciais de redução apresentados a seguir, o valor do potencial da pilha mencionada, em Volts (V), é igual a
Dados:
Al3+ + 3e- ⇌ Al E0 = -1,66 V
Fe2+ + 2e- ⇌ Fe E0 = -0,44 V
A equação química não balanceada, apresentada a seguir, demonstra a reação do permanganato de potássio com peróxido de hidrogênio em meio ácido.
mKMnO4 + nH2SO4 + oH2O2 → pK2SO4 + qH2O + rO2 + sMnSO4
Considerando o balanceamento adequado da equação, a somatória dos coeficientes estequiométricos dos reagentes é igual a