Questões de Concurso Público IF Goiano 2023 para Técnico de Laboratório/Área: Química
Foram encontradas 10 questões
Ano: 2023
Banca:
IV - UFG
Órgão:
IF Goiano
Prova:
CS-UFG - 2023 - IF Goiano - Técnico de Laboratório/Área: Química |
Q2258080
Química
Um dos tipos mais comuns de reações que ocorrem em
solução aquosa é a reação de precipitação. Ela é caracterizada
pela formação de um produto insolúvel que se separa da
solução. Considerando a reação entre fosfato de potássio e
nitrato de cálcio aquosos, haverá a formação de apenas um
produto insolúvel. A fórmula molecular correspondente a
esse produto é
Ano: 2023
Banca:
IV - UFG
Órgão:
IF Goiano
Prova:
CS-UFG - 2023 - IF Goiano - Técnico de Laboratório/Área: Química |
Q2258081
Química
A cinética química estuda a velocidade com que ocorrem as
reações químicas, que, por sua vez, mostra a variação da
concentração de um reagente ou de um produto com o
tempo (mol L-1 s-1). A reação, em meio aquoso, entre bromo
molecular e grande excesso de ácido fórmico é representada
pela equação química balanceada a seguir.
Br2(aq) + HCOOH(aq) → 2Br- (aq) + 2H+ (aq) + CO2(g)
Sabendo-se que a concentração inicial do bromo é 0,120 mol L-1 e que, após 200 s, diminui para 0,060 mol L-1 , determina-se que a constante de velocidade da reação, em s-1, é igual a
Br2(aq) + HCOOH(aq) → 2Br- (aq) + 2H+ (aq) + CO2(g)
Sabendo-se que a concentração inicial do bromo é 0,120 mol L-1 e que, após 200 s, diminui para 0,060 mol L-1 , determina-se que a constante de velocidade da reação, em s-1, é igual a
Ano: 2023
Banca:
IV - UFG
Órgão:
IF Goiano
Prova:
CS-UFG - 2023 - IF Goiano - Técnico de Laboratório/Área: Química |
Q2258082
Química
Uma célula galvânica é constituída por um eletrodo de
magnésio (Mg), mergulhado em uma solução 1,0 mol L-1 de
Mg2+, e por um eletrodo de prata (Ag), mergulhado em uma
solução 1,0 mol L-1 de Ag+. Dados os potenciais padrões de
redução a seguir.
Ag+ (aq) + e- (aq) → Ag(s) E° = 0,80 V Mg2+(aq) + 2e- (aq) → Mg(s) E° = -2,37 V
Determina-se que o potencial padrão da célula em volts, a 25 °C, é
Ag+ (aq) + e- (aq) → Ag(s) E° = 0,80 V Mg2+(aq) + 2e- (aq) → Mg(s) E° = -2,37 V
Determina-se que o potencial padrão da célula em volts, a 25 °C, é
Ano: 2023
Banca:
IV - UFG
Órgão:
IF Goiano
Prova:
CS-UFG - 2023 - IF Goiano - Técnico de Laboratório/Área: Química |
Q2258083
Química
Em um laboratório, são utilizadas diferentes vidrarias para
medir volumes de líquidos. Dentre elas, são exemplos de
vidrarias empregadas para medir volumes exatos de líquidos:
Ano: 2023
Banca:
IV - UFG
Órgão:
IF Goiano
Prova:
CS-UFG - 2023 - IF Goiano - Técnico de Laboratório/Área: Química |
Q2258084
Química
Ácidos concentrados comerciais são amplamente utilizados
em laboratório de ensino e pesquisa em reações químicas.
Uma forma de uso convencional é o emprego de soluções
diluídas desses ácidos. Suponha que um químico preparou
25,0 mL de uma solução aquosa 1,0 mol L-1 de ácido
clorídrico (HCl) a partir do ácido concentrado disponível em
estoque (considere: massa molar HCl = 36,5 g mol-1; Teor
% (m/m) = 36,5 – 38,5% e d = 1,19 g mL-1). O volume
utilizado do ácido concentrado, em mL, para preparar a
referida solução foi igual a
Ano: 2023
Banca:
IV - UFG
Órgão:
IF Goiano
Prova:
CS-UFG - 2023 - IF Goiano - Técnico de Laboratório/Área: Química |
Q2258085
Química
O modelo de repulsão dos pares de elétrons da camada de
valência, RPECV, fornece um método confiável de prever as
formas das moléculas e dos íons poliatômicos. Ele é
baseado na ideia de que pares de elétrons isolados e de
ligação na camada de valência de um elemento repelem uns
aos outros e buscam ficar o mais longe possível uns dos
outros, sendo possível, então, determinar a geometria de
uma dada molécula ou íon. A aplicação desse modelo ao
íon tetracloroiodato, ICl4-
, informa que esse íon possui
geometria molecular
Ano: 2023
Banca:
IV - UFG
Órgão:
IF Goiano
Prova:
CS-UFG - 2023 - IF Goiano - Técnico de Laboratório/Área: Química |
Q2258086
Química
O balanceamento de equações químicas é a etapa mais
importante no estudo prévio de reações químicas. Ele
envolve o ajuste dos coeficientes estequiométricos, de
modo que o número de átomos de cada elemento seja igual
em ambos os lados da equação, ou seja, no lado do(s)
reagente(s) e do(s) produto(s). Considere a equação a
seguir.
Cu(s) + HNO3(aq) → Cu(NO3)2(aq) + NO(g) + H2O(l)
Balanceando-se a equação de oxirredução acima com algarismos inteiros, determina-se que o somatório de todos os seus coeficientes estequiométricos é igual a
Cu(s) + HNO3(aq) → Cu(NO3)2(aq) + NO(g) + H2O(l)
Balanceando-se a equação de oxirredução acima com algarismos inteiros, determina-se que o somatório de todos os seus coeficientes estequiométricos é igual a
Ano: 2023
Banca:
IV - UFG
Órgão:
IF Goiano
Prova:
CS-UFG - 2023 - IF Goiano - Técnico de Laboratório/Área: Química |
Q2258087
Química
Ácidos fracos são espécies químicas muito pouco dissociadas
em meio aquoso. Um exemplo é o ácido acético (CH3COOH),
que possui uma constante de dissociação ácida, Ka, igual a
1,8x10-5 e está em equilíbrio com os íons acetato, CH3COOe próton, H+
, conforme a equação a seguir.
CH3COOH(aq) ⇄ CH3COO- (aq) + H+ (aq)
Dado: pH = -log [H+]
Suponha que foi preparada, em laboratório, uma solução aquosa de ácido acético 0,2 mol L-1. O pH dessa solução possui valor aproximado de
CH3COOH(aq) ⇄ CH3COO- (aq) + H+ (aq)
Dado: pH = -log [H+]
Suponha que foi preparada, em laboratório, uma solução aquosa de ácido acético 0,2 mol L-1. O pH dessa solução possui valor aproximado de
Ano: 2023
Banca:
IV - UFG
Órgão:
IF Goiano
Prova:
CS-UFG - 2023 - IF Goiano - Técnico de Laboratório/Área: Química |
Q2258088
Química
O fenômeno do decaimento radioativo ocorre naturalmente
quando o núcleo de um átomo de determinado elemento
químico se torna instável e, consequentemente, se fragmenta,
emitindo radiações eletromagnéticas e desintegrando-se.
Um dos principais tipos é o decaimento beta, que promove
Ano: 2023
Banca:
IV - UFG
Órgão:
IF Goiano
Prova:
CS-UFG - 2023 - IF Goiano - Técnico de Laboratório/Área: Química |
Q2258089
Química
A acidez de frutas cítricas, como a laranja e o limão, é devido
à presença do ácido 2-hidroxi-1,2-3-propanotricarboxílico,
mais conhecido por ácido cítrico, C6H8O7 (massa molar =
192,0 g mol-1). A sua estrutura é mostrada na figura a seguir. 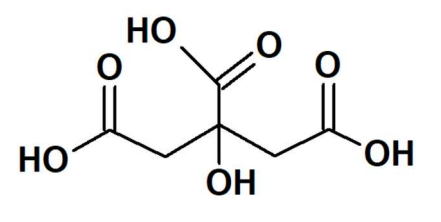
Para se determinar o teor percentual massa/volume (% m/V) em um determinado limão, coletou-se 2,0 mL do sumo deste limão e titulou-se, em triplicata, através de técnica adequada, com solução padronizada de NaOH 0,110 mol L-1 na presença de indicador fenolftaleína até atingir o ponto de equivalência. Gastou-se, em média, 12,0 mL da base. Desta forma, o valor calculado para o teor % (m/V) de ácido cítrico no limão é igual a

Para se determinar o teor percentual massa/volume (% m/V) em um determinado limão, coletou-se 2,0 mL do sumo deste limão e titulou-se, em triplicata, através de técnica adequada, com solução padronizada de NaOH 0,110 mol L-1 na presença de indicador fenolftaleína até atingir o ponto de equivalência. Gastou-se, em média, 12,0 mL da base. Desta forma, o valor calculado para o teor % (m/V) de ácido cítrico no limão é igual a