Questões de Concurso Público Prefeitura de Teresina - PI 2016 para Técnico de Nível Superior - Analista Ambiental - Química
Foram encontradas 23 questões
Atenção: Para responder à questão, considere as informações abaixo.

Onde n e n’ na figura, são valores diferentes.
“O LAS (Alquilbenzeno Linear Sulfonato) é uma mistura de inúmeros homólogos e isômeros com diferentes massas moleculares (Tabela 1). Nessa mistura estão presentes homólogos que possuem número de átomos de carbono diferentes na cadeia alquílica. A posição do grupo assinalado na cadeia carbônica tem-se os diversos isômeros de um determinado homólogo. Os isômeros externos (IE) são aqueles em que o grupo assinalado está mais próximo ao átomo de carbono terminal da cadeia alquílica, enquanto que os isômeros internos (II) são aqueles que o grupo assinalado está mais distante.”
(Extraído e adaptado de: http://www.maxwell.vrac.puc-rio.br/16388/16388_3.PDF. p.24)
Atenção: Para responder à questão, considere as informações abaixo.

Onde n e n’ na figura, são valores diferentes.
“O LAS (Alquilbenzeno Linear Sulfonato) é uma mistura de inúmeros homólogos e isômeros com diferentes massas moleculares (Tabela 1). Nessa mistura estão presentes homólogos que possuem número de átomos de carbono diferentes na cadeia alquílica. A posição do grupo assinalado na cadeia carbônica tem-se os diversos isômeros de um determinado homólogo. Os isômeros externos (IE) são aqueles em que o grupo assinalado está mais próximo ao átomo de carbono terminal da cadeia alquílica, enquanto que os isômeros internos (II) são aqueles que o grupo assinalado está mais distante.”
(Extraído e adaptado de: http://www.maxwell.vrac.puc-rio.br/16388/16388_3.PDF. p.24)
Baseados na Tabela 1 e no texto, considere:
I. Os isômeros externos e internos do mesmo homólogo apresentam diferenças de solubilidade.
II. A solubilidade entre os homólogos é inversamente proporcional ao aumento da cadeia linear.
III. O tamanho da cadeia linear e a posição do grupamento na cadeia alquílica interfere na constante de biodegradação (k).
IV. O coeficiente de partição no lodo varia de acordo com a posição do radical (interno ou externo) sendo maior na fração C10.
Está correto o que consta APENAS em
Atenção: Para responder à questão, considere as informações abaixo.

Onde n e n’ na figura, são valores diferentes.
“O LAS (Alquilbenzeno Linear Sulfonato) é uma mistura de inúmeros homólogos e isômeros com diferentes massas moleculares (Tabela 1). Nessa mistura estão presentes homólogos que possuem número de átomos de carbono diferentes na cadeia alquílica. A posição do grupo assinalado na cadeia carbônica tem-se os diversos isômeros de um determinado homólogo. Os isômeros externos (IE) são aqueles em que o grupo assinalado está mais próximo ao átomo de carbono terminal da cadeia alquílica, enquanto que os isômeros internos (II) são aqueles que o grupo assinalado está mais distante.”
(Extraído e adaptado de: http://www.maxwell.vrac.puc-rio.br/16388/16388_3.PDF. p.24)
Atenção: Para responder à questão, considere, também, as informações abaixo.
Além do LAS, outros agentes tensoativos podem poluir efluentes domésticos. Entre eles estão o brometo de cetiltrimetilamônio (CETAB) e o éter monododecílico do trietilenoglicol – comuns em formulações de shampoos – cujas fórmulas estruturais são representadas abaixo.
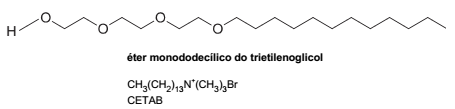
Comparando-se as estruturas do LAS, CETAB e éter monodecílico do trietilenoglicol, elas são classificadas, correta e
respectivamente, em tensoativo
Atenção: Para responder à questão, considere as informações abaixo.
A principal fonte de sulfeto em águas naturais é o lançamento de esgotos sanitários e de efluentes industriais que contenham sulfato, em condições anaeróbias. Devido à ação biológica, ocorre a transformação do sulfato. Em menor proporção, o íon sulfeto pode também ser gerado da decomposição biológica de matéria orgânica contendo enxofre, notadamente as proteínas albuminoides. A seguinte equação química (não balanceada) representa a redução de sulfato a sulfeto em meio anaeróbio pelas bactérias do gênero Desulphovibrio desulphuricans:”
(w)SO42- + (x)C + (y) H2O → (z1) (HCO3)- + (z2) H2S
(Extraído e adaptado de: http://www.leb.esalq.usp.br/disciplinas/Fernando/leb360/Fasciculo%207%20-%20Anions%20em%20Aguas.pdf. P.5)
Os coeficientes de balanceamento w, x, y, z1 e z2 na equação acima são, correta e respectivamente,
Atenção: Para responder à questão, considere as informações abaixo.
A principal fonte de sulfeto em águas naturais é o lançamento de esgotos sanitários e de efluentes industriais que contenham sulfato, em condições anaeróbias. Devido à ação biológica, ocorre a transformação do sulfato. Em menor proporção, o íon sulfeto pode também ser gerado da decomposição biológica de matéria orgânica contendo enxofre, notadamente as proteínas albuminoides. A seguinte equação química (não balanceada) representa a redução de sulfato a sulfeto em meio anaeróbio pelas bactérias do gênero Desulphovibrio desulphuricans:”
(w)SO42- + (x)C + (y) H2O → (z1) (HCO3)- + (z2) H2S
(Extraído e adaptado de: http://www.leb.esalq.usp.br/disciplinas/Fernando/leb360/Fasciculo%207%20-%20Anions%20em%20Aguas.pdf. P.5)
“O enxofre ligado ao oxigênio consiste principalmente de sulfato de ésteres, como o sulfato de colina, sulfatos fenólicos e polissacarídeos e lipídios sulfatados. Essa fração constitui em média cerca de 50% do enxofre orgânico e é obtida pela reação do H2S com ácido iodídrico (HI).”
Fórmulas da colina e seu respectivo sulfato:
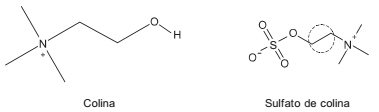
A ligação assinalada (no local pontilhado) é
Considere a reação química entre sulfeto e ácido iodídrico (não balanceada) abaixo.
S2− + I2 + H+ → S + HI
O número de oxidação para o
Atenção: Para responder à questão, considere as informações abaixo.
A produção de metano no biogás através de biodigestores pode ser realizada através de digestão anaeróbia por duas classes de bactérias metanogênicas, as hidrogenotróficas e as acetoclásticas. As produções de metano por estas bactérias estão representadas pelas equações (1) e (2), respectivamente. O processo representado pela equação 2 é responsável pela produção de 70% do metano.
Dados:
R = 0,082 atm.L. K−1
4 H2(g) + CO2(g)  CH4(g) + 2H2O (l) (1)
CH4(g) + 2H2O (l) (1)
CH3COOH(l)  CH4(g) + CO2 (g) (2)
CH4(g) + CO2 (g) (2)
(Extraído e adaptado de: http://www.tcc.sc.usp.br/tce/disponiveis/18/180500/tce.../Oliveira_Rafael_Deleo_e.pdf)
Para uma produção de 173 m3 de biogás (a 25°C, 1 atm de pressão) e com 80% de metano na mistura, a massa total de metano,
água e dióxido de carbono são, em kg, aproximada e respectivamente:
Atenção: Para responder à questão, considere as informações abaixo.
A produção de metano no biogás através de biodigestores pode ser realizada através de digestão anaeróbia por duas classes de bactérias metanogênicas, as hidrogenotróficas e as acetoclásticas. As produções de metano por estas bactérias estão representadas pelas equações (1) e (2), respectivamente. O processo representado pela equação 2 é responsável pela produção de 70% do metano.
Dados:
R = 0,082 atm.L. K−1
4 H2(g) + CO2(g)  CH4(g) + 2H2O (l) (1)
CH4(g) + 2H2O (l) (1)
CH3COOH(l)  CH4(g) + CO2 (g) (2)
CH4(g) + CO2 (g) (2)
(Extraído e adaptado de: http://www.tcc.sc.usp.br/tce/disponiveis/18/180500/tce.../Oliveira_Rafael_Deleo_e.pdf)
Atenção: Para responder à questão, considere as informações abaixo.
“Polímero de grande consumo no Brasil, principalmente devido ao seu uso na fabricação de garrafas para refrigerantes. Características como excelente resistência ao ataque de substâncias, resistência a deformações, baixo nível de absorção de umidade e baixo custo tornaram o PET Poli (tereftalato de etileno) um dos plásticos mais consumidos no mundo”.
(Extraído e adaptado de: PIATTI, Tania Maria e RODRIGUES, Reinaldo Augusto Ferreira. Plásticos: características, usos, produção e impactos ambientais. Maceió/AL, 2005)
A fórmula estrutural do polímero linear está representada abaixo:

Atenção: Para responder à questão, considere as informações abaixo.
“Polímero de grande consumo no Brasil, principalmente devido ao seu uso na fabricação de garrafas para refrigerantes. Características como excelente resistência ao ataque de substâncias, resistência a deformações, baixo nível de absorção de umidade e baixo custo tornaram o PET Poli (tereftalato de etileno) um dos plásticos mais consumidos no mundo”.
(Extraído e adaptado de: PIATTI, Tania Maria e RODRIGUES, Reinaldo Augusto Ferreira. Plásticos: características, usos, produção e impactos ambientais. Maceió/AL, 2005)
A fórmula estrutural do polímero linear está representada abaixo:

Atenção: Para responder à questão, considere as informações abaixo.
“O sulfeto de hidrogênio é coletado aspirando-se um determinado volume de ar através de uma suspensão alcalina de hidróxido de cádmio. O sulfeto é precipitado como sulfeto de cádmio, evitando a oxidação pelo ar do sulfeto, que ocorre rapidamente numa solução alcalina aquosa. Antes da amostragem, adiciona-se arabinogalactana à borra de hidróxido de cádmio, minimizando-se assim a fotodecomposição do sulfeto de cádmio precipitado. O sulfeto coletado é subsequentemente determinado por medição espectrofotométrica do azul de metileno produzido pela reação do sulfeto com uma solução fortemente ácida do composto X e cloreto de ferro (III) de acordo com a reação a seguir”.
(Extraído e adaptado de: “Determinação do Teor de Sulfeto de Hidrogênio na Atmosfera (Método do Azul de Metileno)” Original contido no manual “Métodos de Amostragem no Ar e Análise”. LODGE, J.P.; Lewis Publishers Inc. 3. ed. 1989, Seção 701, p. 486-492, Trad. José Walderley Coelho Dias, Rio de Janeiro, 12 de Novembro de 2003)

Atenção: Para responder à questão, considere as informações abaixo.
“O sulfeto de hidrogênio é coletado aspirando-se um determinado volume de ar através de uma suspensão alcalina de hidróxido de cádmio. O sulfeto é precipitado como sulfeto de cádmio, evitando a oxidação pelo ar do sulfeto, que ocorre rapidamente numa solução alcalina aquosa. Antes da amostragem, adiciona-se arabinogalactana à borra de hidróxido de cádmio, minimizando-se assim a fotodecomposição do sulfeto de cádmio precipitado. O sulfeto coletado é subsequentemente determinado por medição espectrofotométrica do azul de metileno produzido pela reação do sulfeto com uma solução fortemente ácida do composto X e cloreto de ferro (III) de acordo com a reação a seguir”.
(Extraído e adaptado de: “Determinação do Teor de Sulfeto de Hidrogênio na Atmosfera (Método do Azul de Metileno)” Original contido no manual “Métodos de Amostragem no Ar e Análise”. LODGE, J.P.; Lewis Publishers Inc. 3. ed. 1989, Seção 701, p. 486-492, Trad. José Walderley Coelho Dias, Rio de Janeiro, 12 de Novembro de 2003)

Considere a seguinte reação nuclear:

O isótopo Ra-223, em relação ao isótopo Rn-219, possui
No processo de tingimento de fibras de nylon, o efluente não tratado do banho de corante na fibra foi preparado com solução
tampão de ácido acético e acetato de sódio, em uma concentração de 0,60 g .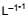 e 1,64 g . L−1, respectivamente.
e 1,64 g . L−1, respectivamente.
Dados:
log1 = 0; log0,5 = −0,3 log2 = 0,3
pKa do ácido acético = 4,74
massas molares (g.mol−1): ácido acético = 60; acetato de sódio = 82
O pH estimado do efluente será
A hidrólise de sais de alguns metais pode levar à formação de acidez mineral nas águas, como ocorre nas estações de tratamento de águas para abastecimento público, por exemplo, com cloreto de ferro (III) ou sulfato de alumínio, conforme indicado nas equações químicas (I) e (II) abaixo.
(I) Al2(SO4)
3(aq) + 6H2O  2Al(OH)3(s) + 6H+
(aq) + 3SO42- (aq)
2Al(OH)3(s) + 6H+
(aq) + 3SO42- (aq)
(II) FeCl3(aq) + 3H2O  Fe(OH)3(s) + 3H+
(aq) + 3Cl−
(aq)
Fe(OH)3(s) + 3H+
(aq) + 3Cl−
(aq)
Para uma solução com 2 mol.L−1 de sulfato de alumínio e 3 mol.L−1 de cloreto férrico, para reação com 100% de rendimento,
tem-se, em mol.L−1, para as equações (I) e (II), respectivamente,
“O cromo pode ser liberado para o ambiente por meio de resíduos originados de um amplo número de processamentos industriais, incluindo a indústria curtumeira, têxtil e de metalurgia do ferro, aço e outros metais. Dentre as formas normalmente encontradas na natureza, o cromo hexavalente apresenta-se como cromatos e dicromatos (CrO42- e Cr2O72- ), os quais são tóxicos e mutagênicos, solúveis em uma ampla faixa de pH e geralmente móveis no sistema solo/água. O cromo trivalente apresenta-se na forma do cátion Cr3+ e do ânion CrO2- , sendo consideravelmente menos tóxico e de baixa mobilidade, em razão de sua precipitação como óxidos e hidróxidos em pH superior a 5,0.”
Um dos processos de transformação do cromo hexavalente tóxico em cromo trivalente menos tóxico, é a reação destes compostos com ferro puro ou cátion Fe2+ como mostram as reações abaixo (a 25 ºC e 1 atm).
Fe(s) + CrO42−(aq) + 4H2O(l)  Fe(OH)3(s) + Cr(OH)3(s) + 2OH−(aq)
Fe(OH)3(s) + Cr(OH)3(s) + 2OH−(aq)
6Fe2+(aq) + Cr2O72−(aq) + 14H+  6Fe3+(aq) + 2Cr3+(aq) + 7H2O(l)
6Fe3+(aq) + 2Cr3+(aq) + 7H2O(l)
Dados: potenciais de redução em volts (V) a 25 ºC e 1 atm
Fe2+(aq)  Fe3+(aq) + e− E0 = −0,77
Fe3+(aq) + e− E0 = −0,77
Fe0(s)  Fe3+(aq) + 3e− E0 = 0,04
Fe3+(aq) + 3e− E0 = 0,04
CrO42−(aq) + 4H2O(l) + 3e−  Cr(OH)3(s) + 2OH−(aq) E0 = −0,12
Cr(OH)3(s) + 2OH−(aq) E0 = −0,12
Cr2O72−(aq) + 14H+ (aq) + 6e−  2Cr3+(aq) + 7H2O(l) E0 = 1,33
2Cr3+(aq) + 7H2O(l) E0 = 1,33
Considere as 6 estruturas abaixo.
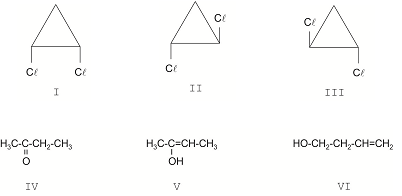
Em relação à isomeria é INCORRETO afirmar que