Questões de Concurso Público SEDU-ES 2016 para Professor - Química
Foram encontradas 40 questões
O óxido de etileno é uma substância muito utilizada na esterilização química de artigos médicos e odontológicos. A esterilização se dá por uma reação de deslocamento “In vivo”, envolvendo uma reação nucleófila de sítio ativo dos ácidos nucleicos no interior da célula com a molécula de Óxido de Etileno; inibindo e modificando a síntese proteica, destruindo o ciclo de vida da célula. A esterilização ocorre através de um mecanismo de alquilação dos grupos funcionais OH e SH destes ácidos nucleicos celulares. Esta ligação inibe a produção de proteínas específicas, e com isto a morte do agente infectante.
Dado: fórmula estrutural do óxido de etileno 
(Extraído e adaptado: Folheto técnico Air Liquide p.5. Disponível em: http://www.br.airliquide.com/file/otherelement/pj/esterelizcom relação à esteroquímica e acao_oxido_de_etileno47295.pdf. Acesso em: 13 dez 2015)
O óxido de etileno é uma substância muito utilizada na esterilização química de artigos médicos e odontológicos. A esterilização se dá por uma reação de deslocamento “In vivo”, envolvendo uma reação nucleófila de sítio ativo dos ácidos nucleicos no interior da célula com a molécula de Óxido de Etileno; inibindo e modificando a síntese proteica, destruindo o ciclo de vida da célula. A esterilização ocorre através de um mecanismo de alquilação dos grupos funcionais OH e SH destes ácidos nucleicos celulares. Esta ligação inibe a produção de proteínas específicas, e com isto a morte do agente infectante.
Dado: fórmula estrutural do óxido de etileno 
(Extraído e adaptado: Folheto técnico Air Liquide p.5. Disponível em: http://www.br.airliquide.com/file/otherelement/pj/esterelizcom relação à esteroquímica e acao_oxido_de_etileno47295.pdf. Acesso em: 13 dez 2015)
Atenção: Considere as informações abaixo para responder a questão.
Breu (ácido abiético, fórmula molecular C19H29COOH) e pentaeritritol (2,2-Bis (hidroximetil)1,3-propanodiol; fórmula molecular C5H12O4) reagem, eliminando água, para formar o composto I, muito utilizado na indústria de tintas e de borracha.

Atenção: Considere as informações abaixo para responder a questão.
Breu (ácido abiético, fórmula molecular C19H29COOH) e pentaeritritol (2,2-Bis (hidroximetil)1,3-propanodiol; fórmula molecular C5H12O4) reagem, eliminando água, para formar o composto I, muito utilizado na indústria de tintas e de borracha.

Atenção: Considere as informações abaixo para responder a questão.
O Eugenol é empregado no alívio da dor de dente, como antisséptico em odontologia e na fabricação de dentifrícios, em perfumaria, saboaria e como clarificador em histologia. O eugenol é também usado como matéria-prima para a obtenção de vanilina que é empregada na aromatização de doces, chocolates, sorvetes e tabacos. A transformação industrial do eugenol em vanilina foi usada industrialmente por muito tempo e está representada abaixo.

Atenção: Considere as informações abaixo para responder a questão.
O Eugenol é empregado no alívio da dor de dente, como antisséptico em odontologia e na fabricação de dentifrícios, em perfumaria, saboaria e como clarificador em histologia. O eugenol é também usado como matéria-prima para a obtenção de vanilina que é empregada na aromatização de doces, chocolates, sorvetes e tabacos. A transformação industrial do eugenol em vanilina foi usada industrialmente por muito tempo e está representada abaixo.

Considere os seguintes compostos:

São isômeros trans e cis do isoeugenol os compostos
O álcool isotridecílico é um álcool graxo muito utilizado na produção de tensoativos não iônicos de aplicação em indústria cosmética e têxtil quando reage com óxido de etileno como representado abaixo.

Considere a tabela, que mostra a relação entre o valor de n da equação com o HLB (balanço lipofílico-hidrofílico) do produto obtido.
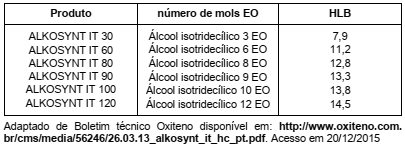
Na tabela observa-se que, em função do número de unidades de óxido de etileno, o HLB varia. Com base nesta observação, é
correto afirmar que a parte
Atenção: Considere as informações abaixo para responder a questão.
Considere as reações incompletas e não balanceadas de oxidação de alcenos por permanganato de potássio:

Atenção: Considere as informações abaixo para responder a questão.
Considere as reações incompletas e não balanceadas de oxidação de alcenos por permanganato de potássio:

Atenção: Considere as informações abaixo para responder a questão.
Considere as reações incompletas e não balanceadas de oxidação de alcenos por permanganato de potássio:

O mau hálito é causado pela presença de substâncias, entre outras, como a cadaverina, putrescina, escatol e ácido isovalérico que são compostos encontrados na decomposição de tecidos orgânicos.
Suas fórmulas estruturais estão representadas abaixo:
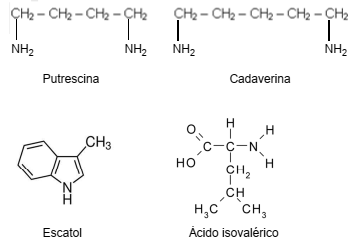
Putrescina e cadaverina, escatol e ácido isovalérico são, respectivamente,
Considere:
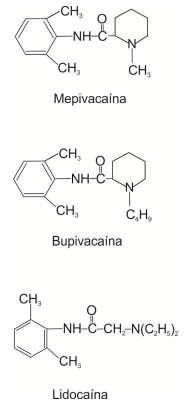
Essas estruturas são de anestésicos locais usados em Odontologia. É correto afirmar que
O peróxido de benzoíla é o princípio ativo de pomadas dermatológicas contra a acne. No entanto, apresenta atividade catalítica em reações de polimerização.
Observe as duas reações abaixo.

(Adaptado de: LÁZARO FILHO, M.; Efeito do Eugenol sobre o endurecimento de Resinas Acrílicas Ativadas Quimicamente e Efeitos de Possíveis Tratamentos Paliativos. Tese de Mestrado. Faculdade de Odontologia da Universidade de São Paulo 2000. p.18)
Sobre as reações, é correto afirmar:
Atenção: Considere as informações abaixo para responder a questão.
A síntese de Haber-Bosch é o método industrial para a produção de amônia utilizada na fabricação de fertilizantes e de muitos outros compostos.
A equação global de reação é dada por:
N2(g) + 3H2(g) ⇋ 2NH3(g) ΔH = −92,22 kcal . mol−1
A tabela abaixo mostra os dados experimentais da reação de síntese da amônia realizada a temperatura e pressão constantes.

Atenção: Considere as informações abaixo para responder a questão.
A síntese de Haber-Bosch é o método industrial para a produção de amônia utilizada na fabricação de fertilizantes e de muitos outros compostos.
A equação global de reação é dada por:
N2(g) + 3H2(g) ⇋ 2NH3(g) ΔH = −92,22 kcal . mol−1
A tabela abaixo mostra os dados experimentais da reação de síntese da amônia realizada a temperatura e pressão constantes.

Considere o sistema tampão entre ácido acético e acetato de sódio. A relação necessária entre concentração de base conjugada e seu ácido, para que o pH da solução tampão seja igual a 7 será
Dados:
pKa (ácido acético/acetato de sódio) = 4,74
O pH de uma solução 0,001 mol/L de NaOH a 25 °C em relação a uma solução 0,0001 mol/L da mesma substância à mesma temperatura será
Dados:
Kw = 1,0 × 10−14
A bateria de chumbo é muito utilizada na indústria automotiva e no funcionamento de no-breaks usados na alimentação elétrica de computadores.
As duas semirreações de redução balanceadas desse sistema são representadas abaixo e são fornecidos os respectivos potenciais padrão (em V):
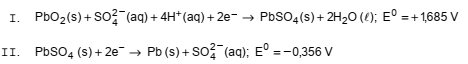
Na descarga dessa bateria, a diferença de potencial do sistema é de, aproximadamente,
Deseja-se efetuar um banho de prata em um anel utilizando-se para tal, uma solução de nitrato de prata. O tempo necessário em segundos para depositar 1,08 g de prata utilizando-se uma corrente contínua de 1 ampère é, em segundos (s),
Dados:
Reação no cátodo: Ag+ (aq) + e− → Ag(s)
Constante de Faraday = 96 500 Coulomb/mol de elétron
Massa atômica da prata (Ag) = 108 g/mol