Questões de Concurso Público SEGEP-MA 2016 para Analista Ambiental – Químico
Foram encontradas 33 questões
As baterias primárias de lítio são alternativas de fornecimento de energia elétrica de longa duração podendo durar até oito anos. Por isso são utilizados em marca-passo cardíaco. A reação global que ocorre nesse tipo de bateria está representada a seguir.
Dados os potenciais de redução:
Li+ (aq) + e− → Li(s); E° = −3,05 V
I2 (s) + 2e− → 2 I− (aq); E° = + 0,54 V
2 Li(s) + 1 I2(s) → 2 LiI(s)
Com relação a esta pilha afirma-se:
I. O potencial da pilha é de 3,59 V.
II. O cátodo é o lítio metálico.
III. No ânodo ocorre a oxidação do iodo.
IV. O oxidante é o iodo I2.
Está correto o que se afirma APENAS em
Dada a reação não balanceada a seguir:
r Fe2+ + s Cr2O72− + t H+ → u Fe3+ + v Cr3+ + w H2O
Completa r, s, t, u, v e w, correta e respectivamente, os coeficientes
Considere a reação 5 Fe2+ + MnO4− + 8H+ → 5 Fe3+ + Mn2+ + 4 H2O utilizada em uma titulação redox para determinação do teor de ferro em 2 g de uma amostra de minério contendo ferro. Nessa titulação foram gastos 47,5 mL de solução 0,02 mol . L−1 de KMnO4 para alcançar o ponto de equivalência. A porcentagem em massa de ferro na amostra é
Dados:
Massas molares (g . mol−1)
K = 39;
Fe = 56;
Mn = 55; O = 16;
H = 1
A decomposição térmica do calcário produz cal e gás carbônico como mostra a reação e a tabela abaixo.

Está correto afirmar que a
Considere o quadro abaixo.
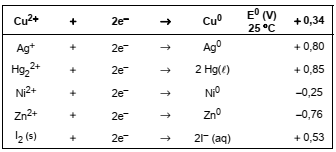
Deseja-se proteger contra a corrosão, chapas de cobre. Analisando-se apenas o potencial padrão de redução deve-se utilizar
O quadro abaixo representa os equilíbrios ácido-base entre o ácido sulfuroso e amônia em solução aquosa.
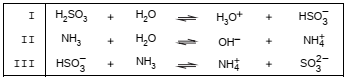
De acordo com a teoria de Brönsted-Lowry,
Noradrenalina e serotonina são dois neurotransmissores existentes no corpo humano.
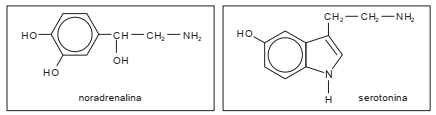
Apresentam em comum as funções:
Deseja-se dessalinizar 1 m3 de água do mar a 25 °C. A pressão osmótica (em atm) a ser aplicada no sistema dessalinizador, considerando-se apenas os íons Na+ e Cℓ − presentes nessa água, é
Dados:
Constante universal dos gases: 0,082 atm . L . mol−1 . K−1
Concentração do sal na água do mar a 25 °C = 2,95 g.L−1
Massas molares (g . mol−1): Na = 23; Cℓ = 35,5
Considerar o NaCℓ totalmente ionizado para cálculo da constante de Van’t Hoff.
A caprolactona pode ser transformada em um polímero sintético biorreabsorvível (policaprolactona ou PCL) muito utilizado em reparação de tecidos humanos.
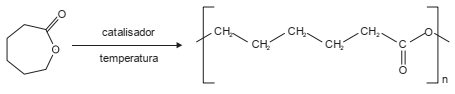
A policaprolactona é um
Considere a reação abaixo.

A hidrólise da PCL gera um composto cujo nome é:
Na combustão da gasolina comum, um de seus componentes − o isooctano é padrão para a qualidade da gasolina. Quanto maior é o índice de octanagem, maior é a compressão que a mistura gasolina-ar suporta no motor, sem detonação prematura; portanto, melhor é a qualidade da gasolina.
A fórmula molecular do isooctano é C8H18. A gasolina pode sofrer combustão completa produzindo CO2 e água ou incompleta − produzindo CO e água ou C (fuligem) e água. Isso ocorre de acordo com a quantidade de oxigênio: combustões completas ocorrem com quantidade de oxigênio suficiente para consumir todo combustível. Por outro lado, a combustão se dá de forma incompleta quando não houver oxigênio suficiente para consumir todo o combustível.
Na combustão da gasolina comum, um de seus componentes − o isooctano é padrão para a qualidade da gasolina. Quanto maior é o índice de octanagem, maior é a compressão que a mistura gasolina-ar suporta no motor, sem detonação prematura; portanto, melhor é a qualidade da gasolina.
A fórmula molecular do isooctano é C8H18. A gasolina pode sofrer combustão completa produzindo CO2 e água ou incompleta − produzindo CO e água ou C (fuligem) e água. Isso ocorre de acordo com a quantidade de oxigênio: combustões completas ocorrem com quantidade de oxigênio suficiente para consumir todo combustível. Por outro lado, a combustão se dá de forma incompleta quando não houver oxigênio suficiente para consumir todo o combustível.
O termo isooctano é um nome indevidamente dado ao composto orgânico cuja fórmula estrutural é representada abaixo.
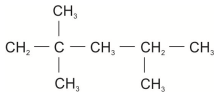
O nome correto (IUPAC) é:
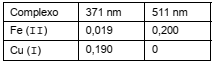
Na determinação de Fe (II) e Cu (I) em uma amostra aquosa, empregou-se o reagente complexante 1,10-fenantrolina, em pH ajustado para 4,5. Os complexos formados apresentaram absorção máxima em 511 nm para o Fe (II) e 371 nm para o Cu (I). Observou-se que a determinação de ferro em 511 nm é isenta da interferência de cobre. Entretanto, em 371 nm ambos os complexos metálicos apresentam absorção. Para a amostra analisada a absorvância medida a 371 nm foi 0,800 e a 511 nm a absorvância foi 0,300. A concentração de Fe (II) e Cu (I) em mg/L, na amostra é, respectivamente:
Dados:
Caminho óptico = 1 cm
Absortividades (L. mg−1 . cm−1)
Considere o gráfico abaixo.
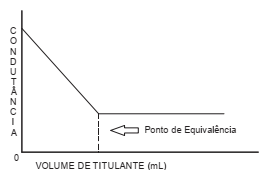
Esse gráfico representa uma titulação condutométrica cuja reação pode ser entre soluções aquosas de
Considere os símbolos abaixo.
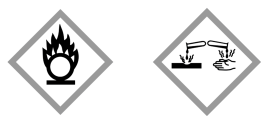
De acordo com o Sistema Globalmente Harmonizado de Classificação e Rotulagem de Produtos Químicos, referido pela sigla
GHS, os símbolos devem constar nos rótulos dos seguintes reagentes (grau P. A.):