Questões de Concurso Público Câmara Legislativa do Distrito Federal 2018 para Consultor Legislativo - Saúde
Foram encontradas 21 questões
A saúde dos adolescentes e adultos jovens tem sido uma preocupação constante no que tange à organização de formas de promoção da saúde e prevenção de doenças nesse ciclo de vida. Considere as exposições deste grupo populacional a fatores de risco, em comparação com indivíduos de outras faixas etárias.
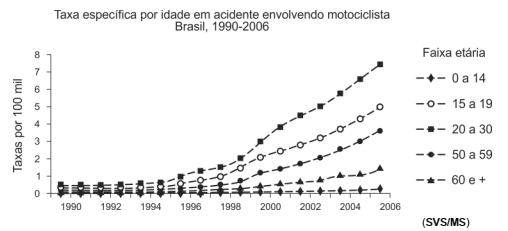
A interpretação do gráfico indica que