Questões de Concurso Público Prefeitura de São José - SC 2018 para Professor - Química
Foram encontradas 20 questões
Quando o dicromato de sódio, Na2 Cr2 O7 , numa reação química se transforma em sulfato de crômio, Cr2 (SO4 ) 3 , cada átomo de crômio:

A partir dos dados extraídos do gráfico responda aos itens abaixo:
Admitindo-se que, para uma certa reação, o segmento AB representa o nível da entalpia dos reagentes e o segmento FG o nível da entalpia dos produtos, podemos afirmar que:
1. A reação direta é exotérmica.
2. A energia de ativação desse processo é representada pelo segmento FG. 3. O perfil do gráfico permite afirmar que a reação direta representa uma reação de combustão. 4. A variação de entalpia (energia) de reação direta é de ΔH = – 600,00 kJ. 5. A reação inversa é exotérmica.
Assinale a alternativa que indica todas as afirmativas corretas.
Analise as afirmativas a seguir:
1. A massa atômica de certo elemento que é apresentada na tabela periódica corresponde à média ponderal das massas atômicas dos seus isótopos naturais.
2. Os nêutrons são partículas subatômicas com carga positiva e têm aproximadamente a mesma massa do elétron.
3. Os isótopos de um elemento têm o mesmo número atômico, mas diferentes números de massa.
4. Para um elemento neutro, a soma do número de prótons e de nêutrons corresponde ao seu número de massa.
5. A disposição dos elementos na tabela periódica está baseada no número atômico do elemento que corresponde à soma dos seus prótons e de seus elétrons.
Assinale a alternativa que indica todas as afirmativas corretas.
Considere certa reação química, representada pela equação genérica abaixo:
A + B → Produtos
Na temperatura de 20°C, apresenta um lei de velocidade (V1 ), V1 = k.[A].[B].
Qual será a sua lei de velocidade (v2 ) na temperatura de 30°C, admitindo-se que essa reação obedece ao princípio de Van’t Hoff, nas mesmas concentrações iniciais dos reagentes.
Considerando os seguintes dados, calcule o calor de combustão do etino, C2 H2, conhecido comercialmente como acetileno.
2C(grafite) + H2 (g) → C2 H2 (g) ∆Hf0 = +226,73 kJ.mol–1
C(grafite) + O2 (g) → CO2 (g) ∆Hf0 = –393,51 kJ.mol–1
H2 (g) + ½O2 (g) → H2 O(l) ∆Hf0 = –285,83 kJ.mol–1
O calor de combustão do acetileno, (∆Hr0 ), é:
Num reator em forma de balão com capacidade de 1,0 litro, numa temperatura de 100,0°C, foram adicionados 1,0 mol de H2 (g) e 1,0 mol de I2 (g).
A figura abaixo apresenta a variação das concentrações com o tempo de H2 (g), I2 (g) e de HI(g).
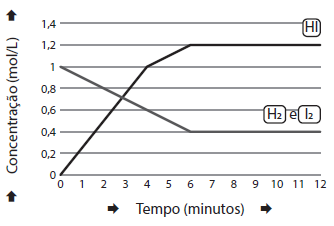
A reação é representada pela equação:
H2
(g) + I2
(g) → 2HI(g)
O valor da constante de equilíbrio é igual a:
dentifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ).
( ) De acordo com o princípio da conservação da energia, a energia não pode ser criada nem destruída, mas somente transformada de uma espécie em outra.
( ) O estado de equilíbrio químico ocorre no momento em que o sistema reacional estaciona e a reação é completada.
( ) Aproximadamente 1,3 kW m-2 da energia radiante solar atinge a Terra, porém somente cerca de 5% desta energia é convertida em carboidratos pela fotossíntese.
( ) Denomina-se “processo exotérmico” aquele que absorve calor e apresenta ∆H > 0.
( ) Aumentar a quantidade dos reagentes é a única maneira de se elevar o valor da constante de equilíbrio de uma reação química.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Para a reação abaixo:
αCr3+(aq) + βMnO2 (s) + γOH– → ρMn2+(aq) + ψCrO4 2–(aq) + ωH2 O(l)
Balanceie a equação esquemática e assinale a alternativa que indica a sequência correta dos coeficientes estequiométricos α, β, γ, ρ, ψ e ω
A Natureza desenvolveu moléculas, aqui designados de “X”, que contêm as instruções genéticas que coordenam a reprodução, o desenvolvimento e funcionamento de todos os seres vivos e alguns vírus, e que transmitem as características hereditárias de cada ser vivo. A sua principal função é armazenar as informações necessárias para a construção de proteínas especiais.
Essa molécula “X”, utilizada pela Natureza para carregar a informação genética de uma geração de células para a próxima, é chamada de:
O acumulador de Chumbo, também conhecido como bateria chumbo-ácido, é utilizado nos automóveis com objetivo de fornecer corrente elétrica para iniciar a ignição do motor e também para a iluminação.
A reação total pode ser representada pela equação:
αPb(s) + βPbO2 (s) + γH2 SO4 (aq) → ψPbSO4 (s) + ωH2 O(l)
Balanceie a equação esquemática e responda às seguintes questões:
1. a sequência correta dos coeficientes estequiométricos α, β, γ, ψ e ω.
2. agente oxidante.
3. agente redutor.
Assinale a alternativa que responde corretamente às questões numeradas.
Há diversas formas de expressar concentração de reagentes em solução ou misturas.
Relacione corretamente as colunas 1 e 2 abaixo.
Coluna 1 Nomenclatura
1. molalidade
2. molaridade
3. fração molar
4. porcentagem massa/massa
Coluna 2 Definições
( ) Relação entre o número de mol do soluto e o volume da solução em litros.
( ) Quociente entre o número de mol do soluto e o número de mol total da solução.
( ) Quociente entre a massa do soluto em gramas e a massa da solução em gramas multiplicado por 100%.
( ) Relação do número de mols do soluto e a massa do solvente em quilogramas.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Sabendo-se que o cloreto de prata, AgCl, e o brometo de prata, AgBr, são muito pouco solúveis em soluções aquosas, calcule o produto de solubilidade das substâncias pouco solúveis a partir das suas solubilidades molares:
1. AgCl = 1,265 × 10–5 mol.L–1
2. AgBr = 8,800 × 10–7 mol.L–1
Assinale a alternativa correta.
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ).
( ) O valor numérico da constante de equilíbrio de reações químicas sofre alteração quando há variação da temperatura da reação.
( ) A velocidade de reações químicas é alterada pela presença de catalisadores e estes (catalisadores) são totalmente consumidos durante a reação.
( ) A diminuição da temperatura de uma reação exotérmica desfavorece a formação de produtos.
( ) O tempo necessário para que a concentração do reagente se reduza a um quarto da concentração inicial é denominado de meia-vida.
( ) As leis de velocidades são determinadas experimentalmente e geralmente não podem ser escritas a partir da estequiometria da equação química da reação.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
O processo denominado de Hall-Héroult, que se constitui na eletrólise ígnea da alumina fundida (Al2 O3 ) na criolita (Na3 AlF6 ), foi patenteado por Charles M. Hall para a obtenção industrial alumínio puro.
A equação química total:
4Al+3(fundido) + 3C(grafita) + 6O–2(fundido) → 4Al(l) + 3CO2 (g)
Calcule, respectivamente, as quantidades de grafita consumida e a massa de CO2 (g) formado quando da produção de 2.700,0 kg de alumínio.
Devido à sua isotonicidade em relação ao sangue humano, o soro fisiológico é normalmente usado para infusão intravenosa.
Calcule, respectivamente, a massa necessária de cloreto de sódio, NaCl, (58,50 g.mol–1) para preparar 5,0 L de soro fisiológico que tenha uma concentração de 0,90% (massa/massa) e a concentração molar dessa solução
Um comerciante de reagentes químicos fornece ácido clorídrico concentrado em cujo rótulo consta que contém 37,50% em massa de HCl (massa molar = 36,5 g.mol–1) e que sua densidade é de d=1,205 g.cm–3.
Calcule o volume necessário desse ácido que deve ser usado para preparar 10,0 L de HCl(aq) de concentração final de 0,7436 mol.L–1.