Questões de Concurso Público FIOCRUZ 2010 para Técnico em Saúde Pública - Química
Foram encontradas 26 questões
Sobre a Cromatografia Gasosa, pode-se afirmar que:
I. A fase móvel é composta por um gás inerte, normalmente nitrogênio, hélio ou hidrogênio.
II. Na cromatografia de partição a fase estacionária é um líquido.
III. Na cromatografia de adsorção a fase estacionária é um sólido.
Assinale.
Uma amostra de uma substância desconhecida A reagiu com uma solução de ácido clorídrico concentrado. Durante a reação foi observada a evolução de um gás que, ao borbulhar em uma solução de cloreto de bário forneceu um precipitado B. A solução resultante da reação A + HCl, ao ser gotejada sobre uma solução de sulfato de sódio, forneceu, por sua vez, um precipitado C.
O ensaio indica que os compostos A, B e C podem ser, respectivamente:
O espectro no Infravermelho de um composto desconhecido apresentou as seguintes bandas: 3100cm-1 (larga), 2940cm-1, 1810 cm-1 (banda principal) e 1420cm-1.
Assinale a substância que melhor corresponde a esse espectro.
O esquema o seguir representa um cromatograma de uma mistura, obtido por meio de um aparelho de Cromatografia Líquida de Alta Eficiência (CLAE).
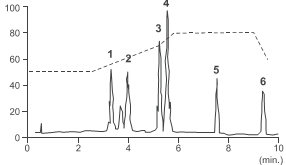
Sabendo que a coluna utilizada era uma coluna de fase
reversa C-18, assinale a afirmativa correta.
Sobre potenciometria, considere as afirmativas a seguir.
I. Em um eletrodo redox, um metal inerte está em contato com uma solução contendo as espécies oxidadas e reduzidas da meia-reação redox.
II. O potencial de Junção Líquida é o causado pela pressão osmótica na interface do eletrodo e deve ser subtraído do potencial medido em soluções concentradas em íons divalentes.
III. Eletrodos de referência devem apresentar potencial fixo e estável e não devem ser afetados pela passagem das pequenas quantidades de corrente elétrica que ocorrem quando se realizam as análises.
IV. Em soluções-teste com pH acima de 9, a presença de íons como o sódio ou o potássio pode resultar em desvios na determinação do pH, registrando valores superiores ao pH real.
Assinale:
A equação química
2 CrCl3 + X NaOH + 3 H2O2 → 2 Na2CrO4 + 6 NaCl + Y H2O
depois de balanceada com os menores coeficientes inteiros
possíveis, apresenta os valores de X e Y, respectivamente,
iguais a:
A indicação da presença de mercúrio em solução pode ser obtida pela observação da formação de precipitado por meio da utilização de soluções de:
I. cromato de potássio
II. ácido clorídrico
III. hidróxido de sódio
IV. nitrato de sódio
Assinale:
Assinale a alternativa que apresente os compostos a seguir na ordem crescente de acidez.
I. Ácido benzóico
II. Ácido p-clorobenzóico
III. Ácido p-toluico
IV. Ácido p-nitrobenzóico
V. Ácido p-hidroxibenzóico
Analise as reações químicas apresentadas a seguir.
I. 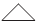 + cl2
+ cl2  Cl-CH2-CH2-CH2-Cl
Cl-CH2-CH2-CH2-Cl
II. 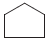 + cl2
+ cl2 
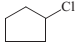 + HCl
+ HCl
Assinale a alternativa correta.
Com relação às características de um padrão interno, para realizar uma análise quantitativa por cromatografia em fase gasosa de alta resolução, analise as afirmativas a seguir.
I. O padrão interno deve formar um complexo estável com a substância a ser quantificada
II. O padrão interno deve ter um tempo de retenção diferente dos outros compostos analisados
III. A eluição do padrão interno deve ser quimicamente semelhante ao composto a ser quantificado
Assinale:
Considere a sequência de reações descrita no esquema a seguir:
1) HNO3/H2SO4
2)Fe/HCl
A 
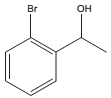
3) NaNO2/HCl
4) CuBr
5) CH3COCl/AlCl3
6) LiAlH4/H+
O composto de partida A será o: