Questões de Concurso Público SEDUC-AM 2014 para Professor - Química
Foram encontradas 30 questões
Assinale a opção que representa a relação entre o número de partículas por unidade de volume (N/V) e as coordenadas volume (V) ou pressão/temperatura (P/T) dos sistemas gasosos.
Nesta avaliação, diversos experimentos foram conduzidos, modificando alguns parâmetros iniciais como temperatura, concentração inicial do ácido e estado de agregação do zinco metálico.
Assinale a opção que apresenta um perfil de volume de H2 em função do tempo esperado para um par de experimentos, variando entre eles apenas um dos parâmetros.
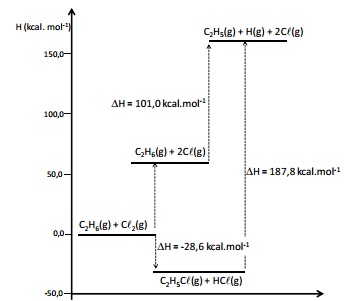
A energia de dissociação de ligação é uma medida da força da ligação química. É definida como a mudança de entalpia padrão observada na quebra homolítica de uma ligação a 0 K. A inclusão de correções térmicas leva os valores de energia de dissociação à entalpia padrão de dissociação, definidos a 298 K.
O diagrama de energia a seguir apresenta as variações de entalpia, a 298 K, para diversos processos.
O gráfico a seguir apresenta a entalpia de combustão, em certa temperatura, para o etano, o propano, o butano, o pentano e o hexano.

