Questões de Concurso Público SEDUC-AM 2014 para Professor - Química
Foram encontradas 60 questões
O pH de uma solução 0,006 mol.L -1 deste ácido, que possui Kaigual a 1,5x10-5 , é, aproximadamente, Dado: log 3 = 0,48
Dados: Eletronegatividades na escala de Pauling B=2,04; O=3,44; Na=0,93; Al=1,61; Si=1,90 e Ca=1,00



Assinale a opção que indica os compostos citados
Considere a reação de combustão total da estearina, balanceada com os menores coeficientes inteiros, produzindo dióxido de carbono e água. A soma destes coeficientes é igual a:
Dados: Números atômicos K = 19 e Ca = 20
(Fonte: http://oglobo..com/sociedade/ciencia/genetica. Acesso em 08/07/2014)
O ácido aristolóquico apresenta a fórmula estrutural:

O octocrileno é representado pela fórmula a seguir.

A concentração de e ácido ascórbico (massa molar 176 g.mol -1 ), em um suco extraído de laranjas, é de 0,704 g.L –1.
O número de mols de ácido ascórbico, em 250 mL do suco destas lanrajas, é:

Considerando que os sais estão totalmente dissociados , a concentração de cloretos na solução de trabalho, expressa em mol.L –1 , é

Assinale a opção que indica a concentração aproximada de pireno nessa solução, expressa em mol.L -1
Dados: Massa molar do pireno 202g.mol -1
ΔT = kcM
onde kc é a constante crioscópica e M é a molalidade total das espécies em solução.
Considere soluções aquosas de e concentrações 5,0x10–3 mol.kg –1 com solutos totalmente dissociados: nitrato de potássio (KNO3) , cloreto de cálcio (CaCl2), nitrato de cádmio ( (Cd(NO3)2), cloreto férrico (FeCl3) e nitrato de alumínio (Al(NO3)3).
A s solução que apresentará o menor abaixamento crioscópico é a do
Um experimento de eletrólise de uma solução de sulfato de cobre (II) foi conduzido por 40 minutos, aplicando-se uma corrente elétrica de 0,4A.
A massa aproximada de cobre que deverá s ser depositada no catodo, em mg, é de
Dados: Massa molar Cu= 63,55 g.mol –1 e constante de Faraday: 96500 C.
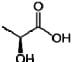
A acidez titulável é expressa em porcentagem ( (massa/volume ) de ácido lático, representado pela fórmula estrutural a seguir:
Em um ensaio, uma alíquota de 10 mL de amostra de leite e foi colocada em um erlenmeyer e adicionou-se duas gotas de fenolftaleína. A titulação da amostra consumiu 1,68mL-1 de solução de NaOH 0,100 mol.L -1 .
A acidez do leite na amostra, expressa em porcentagem, (massa/volume) é de
Dados: Massas molares: H= 1 g.mol –1 ; C= 12 g.mol –1 ; O= 16 g.mol –1 .
Assinale a opção que representa a relação entre o número de partículas por unidade de volume (N/V) e as coordenadas volume (V) ou pressão/temperatura (P/T) dos sistemas gasosos.
Nesta avaliação, diversos experimentos foram conduzidos, modificando alguns parâmetros iniciais como temperatura, concentração inicial do ácido e estado de agregação do zinco metálico.
Assinale a opção que apresenta um perfil de volume de H2 em função do tempo esperado para um par de experimentos, variando entre eles apenas um dos parâmetros.
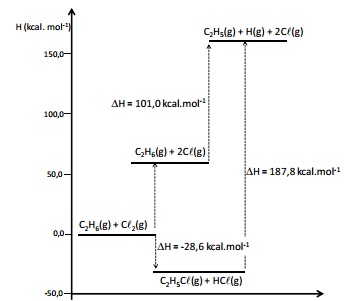
A energia de dissociação de ligação é uma medida da força da ligação química. É definida como a mudança de entalpia padrão observada na quebra homolítica de uma ligação a 0 K. A inclusão de correções térmicas leva os valores de energia de dissociação à entalpia padrão de dissociação, definidos a 298 K.
O diagrama de energia a seguir apresenta as variações de entalpia, a 298 K, para diversos processos.
O gráfico a seguir apresenta a entalpia de combustão, em certa temperatura, para o etano, o propano, o butano, o pentano e o hexano.

