Questões de Concurso Público SEE-PE 2016 para Professor de Química
Foram encontradas 29 questões
Em um laboratório foi montada uma aparelhagem para recolhimento do gás oxigênio produzido na reação de decomposição do clorato de potássio, como ilustra a figura a seguir.
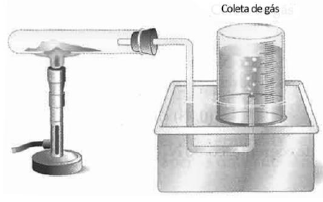
A reação observada pode ser representada pela equação:
2 KClO3 → 2 KCl+ 3 O2
Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente,
Dados: Massa Molar: KClO3 = 122,5 g.mol-1
Constante real dos gases R= 0,082atm.L.mol-1 .K-1
Uma técnica usada em laboratórios químicos é a determinação das fórmulas empíricas (mínimas) pela análise por combustão. Nesse processo, queima-se uma amostra em um tubo por onde passa um fluxo abundante de oxigênio, sendo todo o hidrogênio do composto convertido em água e todo o carbono convertido em dióxido de carbono.
O equipamento utilizado é representado pela figura a seguir.
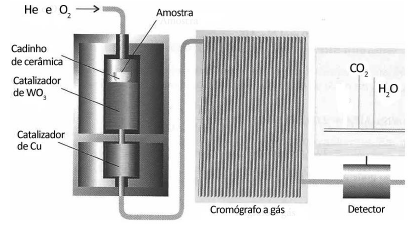
Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água.
A fórmula empírica desse composto é:
Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1