Questões de Concurso Público SEE-PE 2016 para Professor de Química
Foram encontradas 29 questões
Em um laboratório foi montada uma aparelhagem para recolhimento do gás oxigênio produzido na reação de decomposição do clorato de potássio, como ilustra a figura a seguir.
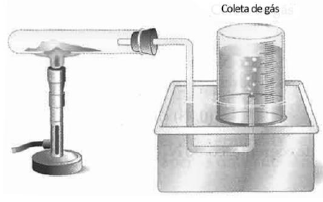
A reação observada pode ser representada pela equação:
2 KClO3 → 2 KCl+ 3 O2
Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente,
Dados: Massa Molar: KClO3 = 122,5 g.mol-1
Constante real dos gases R= 0,082atm.L.mol-1 .K-1
Uma técnica usada em laboratórios químicos é a determinação das fórmulas empíricas (mínimas) pela análise por combustão. Nesse processo, queima-se uma amostra em um tubo por onde passa um fluxo abundante de oxigênio, sendo todo o hidrogênio do composto convertido em água e todo o carbono convertido em dióxido de carbono.
O equipamento utilizado é representado pela figura a seguir.
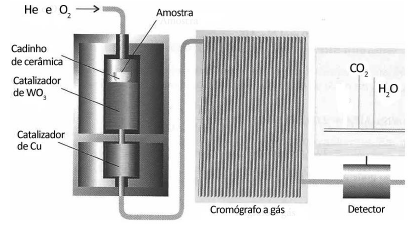
Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água.
A fórmula empírica desse composto é:
Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
 )
) Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
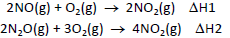
A variação de entalpia da reação N2O(g) + 1/2O2 (g) → 2NO(g) pode ser determinada como
O posicionamento dos metaloides entre os metais e os não-metais é o nosso primeiro exemplo das tendências na variação das propriedades quando nos deslocamos na tabela periódica. Frequentemente veremos que, à medida que mudamos de posição em um período ou em um grupo, as propriedades físicas e químicas variam de modo mais ou menos regular. Há poucas variações abruptas nas características dos elementos quando nos deslocamos horizontalmente ao longo de um período ou verticalmente através de um grupo.
(Brady, J.; Senese, F. Química a matéria e suas transformações Vol 1, 5ª Ed. Rio de janeiro: LTC. 2009)
Com relação aos raios dos átomos, analise as afirmativas a seguir.
I. O raio do ferro é menor que o raio do potássio.
II. O raio do paládio é maior que o raio do níquel.
III. O raio do manganês e maior que o raio do estrôncio
Está correto o que se afirma em
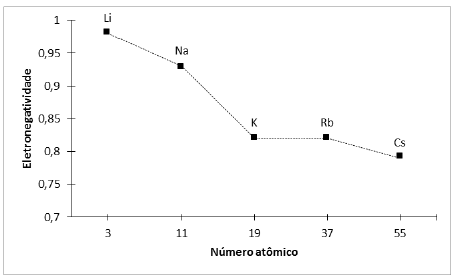
De acordo com os dados apresentados, o metal alcalino que estabelecerá com o flúor a ligação química de maior caráter iônico será o
O fósforo é absorvido pelas plantas na forma de ânions; um desses ânions é o (H2PO4 )- derivado da fluorapatita, encontrada em rochas.
A fluorapatita, representada como Ca5 (PO4 )3F, é insolúvel em água e é convertida a di-hidrogenofosfato de cálcio através da reação não balanceada:
Ca5 (PO4 )3F (s) + H2SO4 (aq) → Ca(H2PO4)2 (aq) + CaSO4 (aq) + HF (g)
A soma dos menores coeficientes inteiros que balanceiam esta
equação é
Um técnico preparou em um balão volumétrico 250 mL de uma solução diluída de ácido clorídrico (a 20ºC), pipetando adequadamente 8,4 mL do ácido concentrado 37% m/m de densidade 1,19 g.cm-3 (a 20ºC).
A concentração da solução preparada, em mol.L-1 é de, aproximadamente,
Dados: Massas molares: H = 1g.mol-1 Cl = 35,5 g.mol-1
Para quantificar sulfato em uma amostra adequadamente preparada foi elaborada uma curva de calibração a partir da diluição de uma solução padrão com concentração 100,0 mg.L-1 . A curva de calibração utilizou as seguintes soluções:
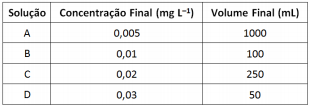
Sobre as soluções preparadas são feitas as afirmativas a seguir.
I. Para preparar as soluções A e C foram utilizados os mesmos volumes da solução padrão.Sobre as soluções preparadas são feitas as afirmativas a seguir.
II. Para preparar a solução B foi utilizado o menor volume da solução padrão.
III. Para preparar a solução D foi utilizado o maior volume da solução padrão.
Está correto o que se afirma em
A análise da concentração de ortofosfato em corpos d’água pode ser feita utilizando o método colorimétrico. Nesse método, o reagente combinado contendo K(SbO)C4H4O6, (NH4)6Mo7O24 e ácido ascórbico reage em meio ácido com o ortofosfato, produzindo uma cor azul, cuja intensidade é determinada no espectrofotômetro.
No preparo de 100 mL do reagente combinado utiliza-se 5 mL de uma solução de K(SbO)C4H4O6 3,5 g.L-1 e 15 mL de uma solução de (NH4)6Mo7O24 40 g.L-1.
Nessa solução do reagente combinado as concentrações
aproximadas (em g.L-1 ) de K(SbO)C4H4O6 e de (NH4)6Mo7O24 são,
respectivamente,
Nos atentados que ocorreram na cidade de Paris em 2015 os terroristas utilizaram o triperóxido de triacetona, o TATP, uma molécula altamente instável que pode ser detonada com facilidade e cuja está representada a seguir.
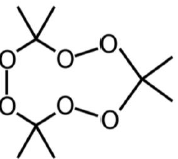
Esta molécula é obtida pela reação da acetona com água oxigenada e, portanto, não contém nitrogênio, tornando mais fácil a sua passagem por dispositivos de segurança que detectam compostos nitrogenados.
Na reação de síntese do TATP citada no enunciado, os carbonos
Cientistas identificaram por meio de métodos cromatográficos que o extrato das folhas de lotus possui alcaloides com efeito psicotrópico. O extrato analisado foi administrado em cobaias e apresentou efeitos que superam os de ansiolíticos atualmente utilizados, com a vantagem de apresentar menos efeitos colaterais.
Entre os alcaloides identificados estão:
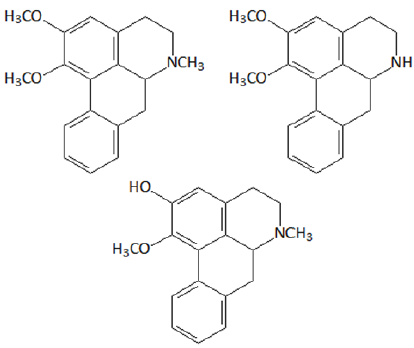
Assinale a opção que indica as funções orgânicas caracterizadas pelos grupos funcionais presentes nessas moléculas.
A fórmula a seguir representa o ácido
7-[(1R,3R)-3-hidróxi-2-[(1E,3S)-3-hidróxi-oct-1-en-1-il] -5-oxo-ciclopentil]heptanoico,
foi uma das primeiras substâncias utilizadas para a impotência masculina. Os fármacos que possuíam esta droga na formulação deveriam ser injetados, o que tornava sua utilização inconveniente.
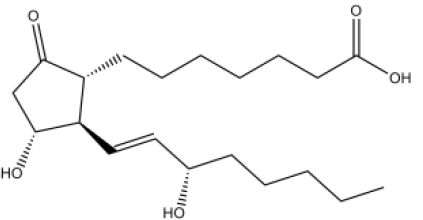
Analisando a nomenclatura e a fórmula desse ácido, é correto
afirmar que seus isômeros