Questões de Concurso Público MAPA 2007 para Químico
Foram encontradas 19 questões
O cerrado brasileiro é uma região onde o relevo predominantemente plano facilita o uso de máquinas agrícolas que desmatam rapidamente grandes extensões de área natural. Abrigando uma vasta diversidade de espécies e importantes bacias hidrográficas, sua rápida ocupação torna-se preocupante, podendo gerar impactos ambientais irreversíveis. Uma das principais ameaças à biodiversidade do cerrado é a monocultura intensiva de grãos, dos quais a soja, com seus insumos, representa a principal cultura em área plantada. O glifosato é um herbicida sistêmico não seletivo pós-emergente e, devido a ser eficiente na eliminação de ervas daninhas e possuir uma baixa toxicidade aos que o manipulam, figura entre os principais agrotóxicos utilizados na cultura da soja na região do cerrado brasileiro. Apesar de ser citado como pouco tóxico, há evidências de efeitos deletérios no ambiente após uso prolongado, devido à resistência adquirida por algumas espécies de ervas. Adicionalmente, é necessário atentar-se para outro risco, visto que a formulação mais comercializada no País contém um surfactante com significativa ação irritativa dermatológica, conhecido como POEA (polietoxietileno amina). O modo primário de ação do glifosato se dá por inibição competitiva da enzima essencial na síntese de aminoácidos aromáticos necessários para o metabolismo de erva daninha, isto é, essenciais à síntese protéica da planta. O ácido aminometilfosfônico (AMPA) é o principal metabólito do glifosato. Composto resultante de sua degradação por microrganismos, embora de baixa toxicidade, apresenta meia-vida em solo várias vezes maior que o glifosato, daí a importância em se desenvolver métodos de extração e análise tanto para glifosato como para AMPA.
(Adaptado de Química nova, Volume 29 nº 6, p. 1372-1376, 2006.)
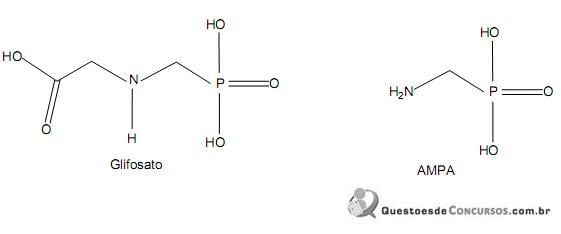
Considerando-se o texto e as moléculas do glifosato e do AMPA acima, são feitas as seguintes afirmativas:
Das afirmativas acima, são verdadeiras apenas:
I – O glifosato é classificado como uma glicina substituída e também como um herbicida organofosforado.
II – Devido ao grupamento cromóforo P(OH)2 O do glifosato e do AMPA, é possível chegar a suas determinações satisfatoriamente utilizando-se cromatografia de alta eficiência com detector de UV-visível.
III – É possível que o uso de surfactante nas novas formulações de herbicidas à base de glifosato se dê em função de sua molécula lhe conferir alta lipofilicidade e baixa solubilidade em água, facilitando a absorção foliar dos inibidores da enzima essencial à síntese de aminoácidos aromáticos.
IV – Na determinação do glifosato em amostras, utiliza-se a cromatografia líquida de alta eficiência com detector de fluorescência, seguida da derivação pós-coluna do glifosato em um composto fluorescente.
V – Os herbicidas comercializados no Brasil à base de glifosato são menos tóxicos que o próprio glifosato puro.
O cerrado brasileiro é uma região onde o relevo predominantemente plano facilita o uso de máquinas agrícolas que desmatam rapidamente grandes extensões de área natural. Abrigando uma vasta diversidade de espécies e importantes bacias hidrográficas, sua rápida ocupação torna-se preocupante, podendo gerar impactos ambientais irreversíveis. Uma das principais ameaças à biodiversidade do cerrado é a monocultura intensiva de grãos, dos quais a soja, com seus insumos, representa a principal cultura em área plantada. O glifosato é um herbicida sistêmico não seletivo pós-emergente e, devido a ser eficiente na eliminação de ervas daninhas e possuir uma baixa toxicidade aos que o manipulam, figura entre os principais agrotóxicos utilizados na cultura da soja na região do cerrado brasileiro. Apesar de ser citado como pouco tóxico, há evidências de efeitos deletérios no ambiente após uso prolongado, devido à resistência adquirida por algumas espécies de ervas. Adicionalmente, é necessário atentar-se para outro risco, visto que a formulação mais comercializada no País contém um surfactante com significativa ação irritativa dermatológica, conhecido como POEA (polietoxietileno amina). O modo primário de ação do glifosato se dá por inibição competitiva da enzima essencial na síntese de aminoácidos aromáticos necessários para o metabolismo de erva daninha, isto é, essenciais à síntese protéica da planta. O ácido aminometilfosfônico (AMPA) é o principal metabólito do glifosato. Composto resultante de sua degradação por microrganismos, embora de baixa toxicidade, apresenta meia-vida em solo várias vezes maior que o glifosato, daí a importância em se desenvolver métodos de extração e análise tanto para glifosato como para AMPA.
(Adaptado de Química nova, Volume 29 nº 6, p. 1372-1376, 2006.)

Dados: Valor enérgico em kJ . g-1: proteínas e carboidratos = 17 ; lipídios = 38 Energia de ligação em kJ . mol -1 : C – H : 412 ; O = O : 496 ; C = O : 743 ; H – O : 463
Dado: KPS Cd(OH) 2 = 3,2 x 10-14 e log 2 = 0,30

Dados: ln 2 = 0,693 e ln 5 = 1,609
(Adaptado de Ciência e Tecnologia de Alimentos, volume 18, número 3, Campinas / 1998.)
(Adaptado de Ciência e Tecnologia de Alimentos, volume 18, número 3, Campinas / 1998.)
Ka1 H2 CO3 = 4,5 x 10-7 e Ka2 H2 CO3 = 5,4 x 10-11 Log 1,5 = 0,18 ; log 2 = 0,30 e log 3 = 0,48
Ka HCOOH = 1,0 x 10-4

Utilizando-se técnicas adequadas, preparou-se 100mL de solução aquosa a partir de uma amostra de 10g dessa ração para analisar-se o teor de cálcio presente.A permanganometria consiste na precipitação do cálcio como oxalato de cálcio, a dissolução do precipitado em ácido e a titulação do ácido oxálico com permanganato


Dados:
Relações molares: 1 mol O2 / 4 mol Fe2+ ; 1 mol Cr2O72- / 6 mol Fe2+ e 6 mol O2 / 4 mol Cr2O72-

I – A sensibilidade do sinal é maior quando a determinação da absorbância dos padrões e da amostra é feita no comprimento de onda de transmitância máxima.
II – O detector tem a função de separar e selecionar a radiação policromática que vem da fonte luminosa no comprimento de onda desejado.
III – Experimentalmente a transmitância decresce exponencialmente quando se aumenta a concentração da solução- padrão de uma mesma substância.
IV – A absorbância diminui quando se aumenta o caminho percorrido pelo fóton na amostra contida na cubeta.
V – O registrador tem a finalidade de gerar um sinal elétrico proporcional à intensidade de luz que sai da cubeta após percorrer a amostra.
Das afirmativas acima, são verdadeiras apenas:

