Questões de Concurso Público UFVJM-MG 2017 para Técnico de Laboratório/Química
Foram encontradas 15 questões
Os compostos moleculares são definidos como átomos ou moléculas unidos por forças intermoleculares.
São compostos moleculares:
Considere que, em um experimento de química, um técnico misturou as soluções de três balões volumétricos em um único recipiente. Os balões tinham as seguintes especificações:
Balão A: 200 mL de NaOH 0,1 mol/L
Balão B: 100 mL de NaOH de concentração desconhecida
Balão C: 200 mL de NaOH 0,05 mol/L
Considerando o volume total da mistura é de 500 mL e que a mistura é totalmente consumida na reação química com 500 mL de ácido clorídrico (HCl) 0,1 mol/L, é correto afirmar que a concentração da solução de NaOH do balão B é igual a:
Os métodos potenciométricos de análise baseiam-se na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Seus valores absolutos de potencial de meia-célula não podem ser determinados no laboratório. Isto é, apenas os potenciais de célula relativos podem ser medidos experimentalmente.
Numere a COLUNA II de acordo com a COLUNA I relacionando os componentes de uma célula às suas principais características.
COLUNA I
1. Eletrodo de referência
2. Ponte salina
3. Eletrodo indicador
COLUNA II
( ) O potencial de junção deve ser extremamente baixo, e, consequentemente, no processamento da célula pode ser desprezado.
( ) Tem um potencial que varia de uma forma conhecida com alterações na concentração de um analito.
( ) O potencial não varia sob temperatura constante, independentemente da composição da solução do analito.
Assinale a sequência CORRETA.
Considere que um estudante trabalhando com duas balanças A e B registrou as seguintes massas de um mesmo material:

Com base nessas informações, o estudante fez as seguintes afirmações:
I. Não há diferença entre as massas.
II. A balança B tem maior incerteza.
III. A balança A tem mais algarismos significativos.
Sobre as proposições descritas, do ponto de vista científico, estão incorretas as afirmações:
Quimicamente, o gás bromo (Br2 ) pode reagir com gás hidrogênio (H2 ) sob aquecimento ou ação da luz, produzindo brometo de hidrogênio (HBr), cuja solução aquosa (ácido bromídrico) corresponde a um hidrácido muito forte.
Considere as equações termoquímicas a seguir.
NH3(g) + HBr(g) → NH4Br(s) H0 = –188,32 kJ
N2(g) + 3H2(g) → 2NH3 (g) H0 = –92,2 kJ
2NH4Br(s) → N2(g) + 4H2(g) + Br2(g) H0 = +541,66 kJ
Baseando-se nessas equações termoquímicas, é correto
afirmar que o valor aproximado da entalpia de reação da
síntese do gás brometo de hidrogênio é igual a:
A formação do gás monóxido de nitrogênio (NO) a partir de gás nitrogênio (N2 ) e gás oxigênio (O2 ) fornece um exemplo prático importante das variações na constante de equilíbrio e velocidade de reação com a temperatura. Considere a equação de equilíbrio e a variação da entalpia padrão a seguir para a reação de formação do gás monóxido de nitrogênio.
½ N2(g) + ½ O2(g)  NO(g) ∆H0 = +90,4 kJ
NO(g) ∆H0 = +90,4 kJ
Sobre o equilíbrio químico envolvido no processo, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) O aumento da temperatura do sistema produz mais monóxido de nitrogênio.
( ) O aumento da temperatura diminui o valor numérico da constante de equilíbrio.
( ) A adição de NO ao sistema aumenta o valor numérico da constante de equilíbrio.
( ) A adição de O2 ao sistema produz mais monóxido de nitrogênio.
Assinale a sequência CORRETA.
A cromatografia é um método físico-químico de separação e está fundamentada na migração diferencial dos componentes de uma mistura, que ocorre devido a diferentes interações, entre duas fases imiscíveis: a fase móvel e a fase estacionária. Entre os vários tipos de cromatografia, destacam-se a cromatografia em camada delgada (CCD), a cromatografia líquida de alta eficiência (CLAE) e a cromatografia gasosa de alta resolução (CGAR).
Sobre os tipos de cromatografia, assinale a alternativa INCORRETA.
Considere que, em um experimento de titulação, um estudante obteve o resultado conforme a figura a seguir.
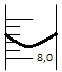
Assinale a alternativa que expressa a leitura correta
feita pelo aluno no volume obtido na bureta em mililitros,
sabendo que sua incerteza é de ±0,01 mL.
O preparo de soluções é uma das atividades essenciais na vida profissional do técnico de laboratório em Química. O hidróxido de sódio é a base mais utilizada no preparo de soluções-padrão, embora os hidróxidos de potássio e de bário sejam também empregados.
Considere que um técnico de laboratório em Química, durante o preparo de uma solução-padrão de hidróxido de sódio (NaOH), realizou os seguintes procedimentos:
I. Considerou o grau de pureza da base, no rótulo do reagente, para calcular a massa do NaOH necessária para o preparo da solução.
II. Colocou a quantidade já pesada da base em um béquer e dissolveu em água destilada, usando um bastão de vidro para facilitar a dissolução.
III. Transferiu, quantitativamente, com o auxílio de uma bureta, o volume total de água que interage com o hidróxido de sódio.
Estão corretos os procedimentos:
Uma substância branca, solúvel em água e sólida A foi aquecida em uma mufla a altas temperaturas. Essa substância se decompõe para formar novas substâncias B e C. A substância B é muito útil na produção de vidros e cerâmicas. A substância C é um gás, da combustão completa entre carbono e oxigênio.
Baseando-se nessas informações, é correto afirmar que as substâncias A,B e C são, respectivamente:
A medição de volumes líquidos é uma parte importante de muitos experimentos. Em alguns casos, os volumes medidos precisam de uma grande precisão, e em outros casos não. Nos laboratórios de Química, o volume pode ser medido de maneira confiável com uma pipeta, uma bureta ou um frasco volumétrico. Sobre as principais vidrarias de precisão, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) As pipetas permitem a transferência de volumes exatamente conhecidos de um recipiente para outro.
( ) Uma bureta consiste em um tubo calibrado para abrigo do titulante mais uma válvula pela qual a vazão do titulante é controlada.
( ) As buretas são utilizadas para a preparação de soluções-padrão e para a diluição de amostras, a volumes fixos, antes da tomada de alíquotas com uma pipeta.
( ) Uma pipeta é utilizada nas titulações durante os processos de preparo e padronização de soluções.
Assinale a sequência CORRETA.
Uma solução aquosa de um soluto desconhecido é testada com papel tornassol azul e apresenta coloração vermelha. A solução é um condutor fraco comparado com uma solução de NaCl da mesma concentração.
A partir dessas informações, é correto afirmar que o soluto dessa solução é o composto:
Considere que um técnico de laboratório busque maneiras de melhorar o processo pela qual o minério de ferro, contendo Fe2O3 , é convertido em ferro. Em seus testes, ele realizou a seguinte reação em pequena escala.
Fe2O3 (s) + 3CO(g) → 2Fe(s) + 3CO2(g)
Nessas condições, admitindo que há 150 g de Fe2O3 como reagente limitante, qual é aproximadamente o rendimento teórico de ferro?
Um composto orgânico apresenta as seguintes características:
- Cadeia ramificada, aberta e homogênea.
- Apenas um carbono quiral.
- Carbono insaturado.
A partir dessas informações, é correto afirmar que o
composto que apresenta todas as características citadas
é o:
Em análises gravimétricas, idealmente, um agente precipitante gravimétrico deve reagir especificamente, ou pelo menos seletivamente, com o analito. Além da especificidade e da seletividade, o reagente precipitante ideal deve provocar uma reação com o analito para formar um produto que seja:
I. Facilmente filtrado e lavado para remoção de contaminantes.
II. Com solubilidade suficientemente baixa para que não haja perda significativa do analito durante a filtração e a lavagem.
III. Não reativo com os constituintes da atmosfera.
Apresentam corretamente características desse produto formado as afirmativas: