Considere que uma solução aquosa contém íons Cr3+.
A uma alíquota de 25 mL dessa solução, é misturado
10 mL do agente complexante 1,2-diaminociclo-hexano
tetracético (CDTA), 0,1 mol/L. Tal mistura foi aquecida
até a temperatura de ebulição, viabilizando, assim,
a complexação do CDTA com íon Cr3+.A mistura é, então,
resfriada e o excesso de CDTA é medido por titulação de
retorno com ions Bi3+ de 0,03 mol/L, consumindo 4 mL
até atingir o ponto final.
Nessas condições, é correto afirmar que a concentração
de íon cromo III na solução é, em mol.L–1, igual a:
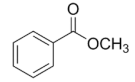 Admite-se que, em uma amostra pura de 2,0 gramas de
metilbenzoato, encontram-se 1,4 gramas de carbono e
0,12 g de hidrogênio.
A partir dessas informações, é correto afirmar que a
fórmula mínima do metilbenzoato é:
Admite-se que, em uma amostra pura de 2,0 gramas de
metilbenzoato, encontram-se 1,4 gramas de carbono e
0,12 g de hidrogênio.
A partir dessas informações, é correto afirmar que a
fórmula mínima do metilbenzoato é: