Questões de Concurso Público SES-PR 2016 para Químico
Foram encontradas 40 questões
Um cilindro contém uma mistura de 88 g de CO2(g) com uma quantidade desconhecida de gás argônio foi mantido em determinadas condições de pressão e temperatura.
Depois de vários testes, descobriu-se que com a adição de 220g de CO2(g) à mistura, mantendo-se temperatura e pressão constantes, o volume dobra.
Assinale a alternativa que apresenta a quantidade de argônio existente na mistura.
Dados: Massa atômica: Ar=40u; C=12u; O=16u
Um tubo inicialmente cheio de água (B) foi conectado a outro tubo (A), ao qual foi adicionada solução de ácido clorídrico e raspas de zinco com alto grau de pureza. O sistema foi fechado e após algum tempo, apresentava-se como indicado na figura.
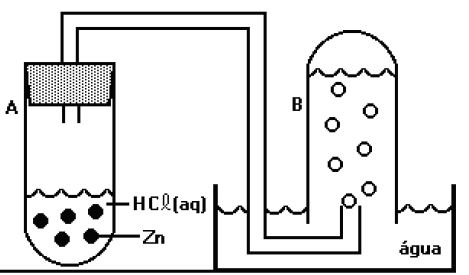
Analise as propostas a seguir:
I. Parte significativa do gás hidrogênio ficará retida na água formando uma solução de caráter ácido.
II. A pressão de vapor da água, na temperatura da realização do experimento, é importante para o cálculo sobre o volume de hidrogênio, caso não se leve em consideração a pressão de vapor da água o valor de gás hidrogênio obtido será maior que o verdadeiro.
III. Quando o nível da água no interior do tubo B se igualar com o nível da água do restante da cuba, pode-se afirmar que a soma da pressão do hidrogênio com a pressão de vapor da água, na temperatura de realização do experimento, será praticamente igual à pressão atmosférica local. Assinale a alternativa que contém as propostas verdadeiras.
Assinale a alternativa que contém as propostas verdadeiras:
Uma das etapas de enriquecimento do urânio consiste na separação do hexafluoreto de urânio, contendo U-235 do U-238, analise o esquema representado a seguir:
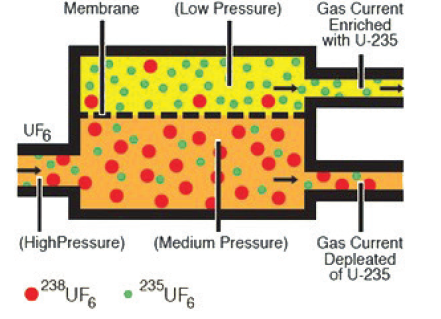
I. Ocorre redução da pressão do sistema naturalmente, pois na linha de entrada da mistura de gases, ocorre uma expansão na chegada a câmara de difusão em membrana.
II. A introdução de um sistema de vácuo na linha do U -235 enriquecido favorece a maior velocidade da separação dos componentes do sistema.
III. A difusão do composto contendo U-238 pela membrana é mais intensa, por isso é necessário reduzir a pressão do sistema garantindo assim a maior passagem pela membrana do composto contendo U – 235.
São verdadeiras as afirmações contidas na alternativa:
A constituição da matéria está presente no vocabulário científico desde a Grécia antiga, mas sem comprovação científica, apenas filosófica. Como conhecimento científico os modelos atômicos foram formulados a partir de 1808 e à medida que novos e melhores métodos de investigação foram sendo desenvolvidos, evoluídos. A seguir, são apresentadas as representações gráficas de alguns modelos atômicos:
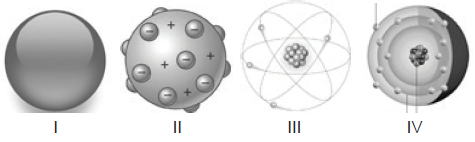
Julgue os itens a seguir:
( ) Dalton, figura I, tomou como base para o desenvolvimento de seu modelo atômico análises de conservação e proporcionalidade da massa em uma reação, originárias de Lavoisier e Proust.
( ) O modelo atômico de Thomson , figura II, apresenta a ideia de descontinuidade pela primeira vez e apresenta a primeira subpartícula atômica encontrada: o elétron.
( ) A figura III representa o modelo atômico de Rutherford, destacando o surgimento da ideia de núcleo positivo, sem os nêutrons que só seriam descobertos por Sommerfeld em 1932.
( ) A figura IV representa o átomo de Chadwick, organizando os níveis de energia eletrônicos pela primeira vez.
Assinale a alternativa que contém a análise correta em verdadeiro (V) e falso (F) para os itens apresentados.
O ácido perclórico P.A. apresenta concentração de 70%, sabendo que a densidade do ácido perclórico é 1,68g/cm-3 , assinale a alternativa que apresente o volume aproximado de solução do ácido que deve ser adicionado a um balão volumétrico de 200mL, afim de preparar uma solução 0,1 mol/L.
Dados M=100,46g.mol-1
A análise quantitativa por espectrofotometria UV/Visível é muito utilizada para doseamento de determinados princípios ativos e corantes em formulações farmacêuticas disponíveis no mercado. Essa análise é confiável desde que obedeça a Lei de Beer, ou seja, a solução analisada deve obrigatoriamente seguir uma relação linear entre a absorbância e a concentração.
Considere a análise de um determinado fármaco que obedece a Lei de Beer. O que aconteceria com o valor de Absorbância se a concentração da solução do fármaco fosse o dobro? Considere que para esta análise utilizou-se uma cubeta de 1,00 cm de caminho óptico. O que aconteceria com o valor de Absorbância se uma nova medida fosse realizada com uma cubeta de 5,00 cm de caminho óptico?
Com base nos seus conhecimentos sobre LC, no texto e nas estruturas das moléculas assinale o que está correto:
Um medicamento à base de ferro pode ter sua concentração conhecida por espectrofotometria UV/ Visível. Utilizando-se um medicamento de referência, realizaram-se as devidas diluições para a construção de uma curva de calibração. As medidas de absorbância, no comprimento de onda de absorção máxima de 510 nm, nas diferentes concentrações do medicamento de referência encontram-se na tabela a seguir:
Concentração (ppm) Absorbância
2,00 0,164
5,00 0,425
8,00 0,628
12,00 0,951
16,00 1,260
20,00 1,582
Os dados obtidos permitiram a construção de uma curva de calibração com coeficiente de correlação (R2) de 0,99978 e equação da reta: A = 0,01478 + 0,07812 x C. Sabendo-se que a absorbância da solução do medicamento à base de ferro foi de 0,715. Analise as propostas:
I. A concentração da amostra analisada é de 8,96 ppm.
II. O analito deve ser colorido, pois o comprimento de onda é na região do visível.
III. A absorbância está relacionada diretamente com a quantidade de radiação que atravessou a amostra analisada.
IV. A curva de calibração construída não se mostrou linear para o trecho estudado.
V. Se a amostra apresentar um valor de absorbância de 1,782 a concentração será de 22,60 ppm.
São corretas:
A figura a seguir apresenta duas curvas quase que sobrepostas, correspondentes ao mesmo procedimento: a curva de titulação entre um fármaco ácido e NaOH e a curva obtida quando se tira a 1ª derivada da curva de titulação. Analise as afirmações e escreva V para verdadeiro ou F para falso:
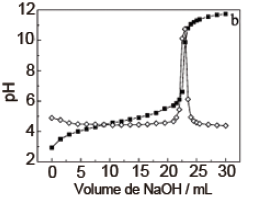
( ) A titulação envolve ácido fraco e base forte, se não fosse potenciométrica a utilização de fenolftaleína como indicador, teria preferência a utilização de alaranjado de metila.
( ) O p.e. (ponto de equivalência) será em pH igual 7.
( ) o pKa do titulado é próximo a 5.
( ) A derivada da curva tem por finalidade indicar o volume gasto até o p.e. para a neutralização.
( ) O sitema atua como um tampão na faixa 4<pH<5,5.
Assinale a alternativa correta quanto ao verdadeiro ou falso:
A figura a seguir apresenta um esquema simplificado de um equipamento de espectrofotometria de absorção molecular, analise as propostas apresentadas:
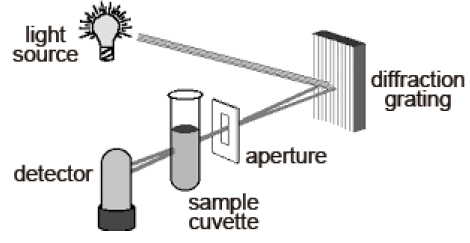
I. A rede de difração seleciona o comprimento de onda para se proceder na investigação, porém a seletividade do sistema está relacionada com a abertura da fenda de passagem de luz, quanto menor a fenda, mais específico será o comprimento de onda selecionado.
II. Absorbância está relacionada com a intensidade de luz visível que a amostra absorveu, sendo que se a cubeta apresentar maior ou menor caminho óptico o sinal de absorbância permanece o mesmo, já que a solução não foi alterada.
III. Soluções muito concentradas podem causar um bloqueio da luz incidente ao passar pela cubeta, fora da proporcionalidade, com isso ocorre um desvio de linearidade, além disso, este sistema também é prejudicado por material particulado ou manchas na superfície da cubeta.
São verdadeiras:
O cromatograma a seguir refere-se a um processo de quantificação de captopril. Com base nas condições cromatográficas e em seus conhecimentos sobre CLAE, analise as propostas:
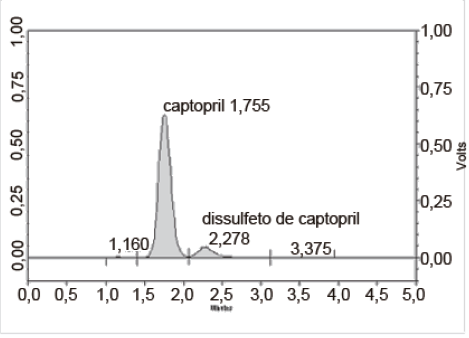
FIGURA 1 - Cromatrogama do captopril padrão secundário, fase móvel mistura de ácido fosfórico 0,11% (vlv) e metanol (45:55), vazão 1 mL/min, coluna C-18, comprimento de onda de detecção 220 nm e resolução média 2.2.
I. Uma boa resolução permite detecção de impurezas ou produtos de degradação do analito, por isso a importância dos sinais serem bandas estreitas.
II. O captopril possui melhor interação com a fase móvel utilizada que o dissulfeto de captopril.
III. A cromatografia foi feita em fase reversa.
IV. A eluição foi por isocrática e a detecção realizada na região do visível.
V. É comum acoplar detectores diferentes em sistemas CLAE.
São verdadeiras:
A irradiação de alimentos e medicamentos tornouse prática importante para ampliar a durabilidade destas substâncias. Expostas às radiações beta e gama, as substâncias que passam por este processo apresentam, além da esterilização, manutenção da sua aparência física e qualidades de sabor.
Analise as proposições a seguir:
I. Um alimento irradiado pode contaminar os demais em um centro de distribuição, com isso há necessidade de embalagens adequadas para evitar contaminações por contato.
II. Os bombardeadores de césio e cobalto são fontes emissoras das radiações beta e gama, ao irradiar uma amostra alimentícia ou medicinal, o material torna-se radioativo por um certo tempo, necessitando de repouso até que transcorra algumas meia-vidas antes de seguir para o centro de distribuição.
III. Apesar de alimentos irradiados serem comuns, não existe uma “dose de pasteurização” definida para cada um deles, pois são tratados de forma empírica um a um.
Assinale a alternativa que contenha apenas proposições verdadeiras:
Um estudante pretende preparar uma solução 2,0 mol L-1 a partir do ácido clorídrico concentrado.
Ao abrir um manual elaborado por estudantes do Ensino Médio se deparou com as seguintes afirmações:
I. “Realizem o procedimento na bancada do laboratório, utilizando avental, óculos de segurança e luvas.”
II. “Retirem uma alíquota do ácido clorídrico concentrado vertendo-a em um béquer, pipetem o volume necessário a partir do béquer e transfira o volume para o balão volumétrico e adicionem água até o menisco e agitem.”
III. “Despejem cuidadosamente o volume pipetado de ácido clorídrico concentrado na água.”
IV. “Evite o contato dos vapores do ácido clorídrico com olhos e mucosas, lavando a mão com água ao término do procedimento.”
É correto apenas o que se afirma em:
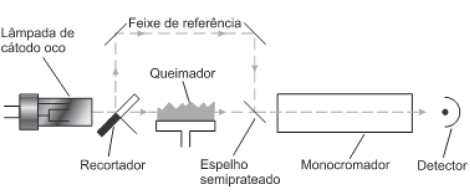
SKOOG, D. WEST, D. M. HOLLER, F. J. CROUCH, S. R Fundamentos de Química Analítica. 8 ed. São Paulo. Cengage Learning. 2010.
Ao considerar a instrumentação e os princípios da técnica analítica em si, analise as afirmações a seguir: I. A lâmpada de cátodo oco, consiste de um ânodo de tungstênio e de um cátodo cilíndrico selado em um tubo de vidro, contendo um gás inerte, como o monóxido de dinitrogênio. II. Como em toda a investigação relativa, há a necessidade de estipular um branco para a análise, já que no queimador podem surgir partículas que influem no sinal detectado e de natureza diferentes das que constituem a amostra analisada. III. A temperatura da chama é responsável pelas etapas de dessolvatação, vaporização e dissociação, bem como a conversão dos íons contidos na amostra em átomos neutros, estes últimos são os responsáveis por absorver o feixe de radiação.
É correto apenas o que se afirma em:
De uma forma geral as águas subterrâneas e superficiais que podem ser tratadas para tornarem-se potáveis, apresentam uma infinidade de contaminantes, ou substâncias indesejáveis ao meio. Por esta razão métodos de tratamento robustos e versáteis ganham espaço a fim de garantir a qualidade da água servida para a população. O esquema a seguir apresenta uma das formas de tratamento de águas subterrâneas.
Dados: Ks [CaSO4] = 1,9.10-4; Ks [Ca3(PO4)2] = 1,1.10-28
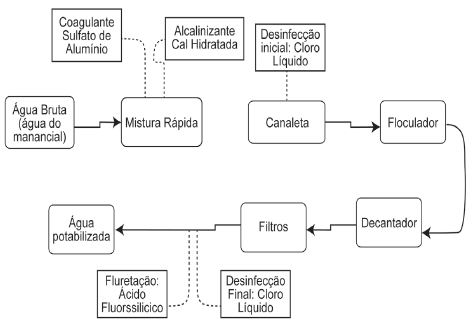
Analise as propostas a seguir:
I. A presença do íon sulfato como coagulante é o procedimento mais comum de tratamento, poderia ser substituída pelo íon fosfato no sistema com a finalidade de reduzir a dureza da água.
II. Após a mistura rápida do coagulante ao sistema devese desacelerar a mistura a fim de que o floco aumente de tamanho, facilitando sua retirada.
III. A faixa de ação do pH ao longo sistema de tratamento varia, com isso garante-se a estabilidade das espécies químicas formadoras do floco e as desinfectantes, que necessitam valores diferentes ao longo do fluxo.
É correto apenas o que se afirma em:
O diagrama a seguir apresenta a relação entre a densidade e a concentração em porcentagem em massa para o hidróxido de sódio (M = 40 g/mol) e o ácido clorídrico (M = 36,5 g/mol).
Em uma situação hipotética, onde as duas soluções apresentem densidade ao redor de 1,1g/cm3 é correto afirmar que as concentrações, em mol/L, para o NaOH e para o HCl serão respectivamente:
A concentração é uma característica importante para análise e interpretações de propriedades para as soluções e um dado necessário para seu uso no laboratório, na indústria e no cotidiano.
Abaixo, estão desenhados recipientes com os respectivos volumes de solução e massas de hidróxido de sódio (NaOH = 40g/mol).
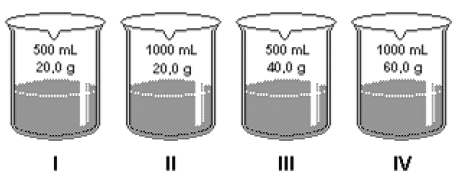
I. A solução contida no frasco I apresenta concentração de 1,0 mol/L;
II. As 4 soluções apresentarão pH acima de 7;
II. A solução mais concentrada está presente no frasco III.
São corretas as afirmações: